냉이의 연구 현황 및 활용 가능성
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Capsella bursa-pastoris (L.) Medik (Brassicaceae), commonly known as 'shepherd's purse', has a long history of use in traditional medicinal use in regions such as Korea, China, and Europe. Numerous studies have revealed its diverse pharmacological properties and identified various metabolites.
In this review, we analyzed numerous studies related to C. bursa-pastoris, which are currently underway. We examined genomic research that has enabled determination of genomic size and origin, as well as transcriptome studies conducted to investigate genes related to environmental stress. We discussed the pharmacological properties of this plant, including its validated anti-inflammatory, anti-oxidant, anti-cancer, and anti-hemorrhagic activities. We also reviewed the various metabolites, including phenols, flavonoids, and sulfur compounds, which have been identified in this plant. We also discuss the biosynthetic pathways of choline and glucosinolates which were investigated using Arabidopsis thaliana, a model plant belonging to the family Brassicaceae, as this research can facilitate future studies on C. bursa-pastoris.
This review provides a comprehensively summarizes the research conducted on C. bursa-pastoris as a traditional resource for use in pharmaceutical applications and foods. This will contribute to future studies focused on enhancing the levels of valuable functional compounds from this plant.
Keywords:
Capsella bursa-pastoris, Cholines, Glucosinolates, Metabolites, Pharmacological Effects서 언
봄나물로 잘 알려진 냉이 [Capsella bursa-pastoris (L.) Medik]는 십자화과 (Brassicaceae)에 속하며 전 세계적으로 분포한다. 냉이는 우리나라에서 식용 및 약용으로 다양하게 사용해 왔으며 여러 고문헌에 기록되어 있다. 또한 임업경영총서에서는 냉이 뿌리가 혈액 순환을 원활하게 하고 간을 실하게 하며 종자는 눈을 맑게 한다고 기록되어 있다 (Choi et al., 2006).
유럽과 아시아의 여러 문헌에도 민간요법으로 냉이에 대한 기록이 존재한다. 영국 요크셔 지역의 민속 이야기에서는 냉이 씨앗 꼬투리를 열어 내부 씨앗의 색을 확인했을 때, 씨앗이 노란색이면 부자가 될 것이고 씨앗이 초록색이면 가난할 것이라고 하였다 (Defelice, 2001).
중국과 일본에서는 냉이를 상처의 출혈을 멈추고 소변 배출량을 증가시키며 체온을 낮추는 등 다양한 의학적 용도로 사용하였다 (Kuroda and Takagi, 1968). 중국의 고전 의학서인 본초강목, 명의별록 등을 통해 중국에서도 냉이를 오랫동안 전통 약초로 활용하였음을 알 수 있으며 (Peng et al., 2019), 백내장 치료 등 다양한 병의 민간요법으로 사용하였다 (Xie et al., 2022). 티베트에서 냉이는 구토를 멈추게 하고 신장, 폐, 신경질환, 체액 저류를 치료하는 데 사용하였으며, 인도 의학에서는 여성 생리 과다출혈, 신장 및 비뇨기관 출혈, 설사 및 이질 치료, 이뇨제 등 다양하게 사용하였다. 또한, 유럽에서 냉이는 지혈제로 사용되었으며 생리통의 치료에도 쓰였다 (Dar et al., 2021).
문헌에 나오는 냉이는 공통적으로 항염증제, 항암제, 항출혈제, 이뇨제, 상처 치유 등으로 사용되고 있었는데 (Qayyum et al., 2018), 실험을 통해 냉이의 항염 (Cha et al., 2017; Lan et al., 2017; Cha et al., 2018; Peng et al., 2019), 항산화 (Grosso et al., 2011; Neagu et al., 2019), 항암 (Kuroda et al., 1976; Lee et al., 2013), 아세틸콜린에스테라아제 억제 (Grosso et al., 2011; Kurt et al., 2018), 간 보호 (Choi et al., 2017), 콜레스테롤 저하 (Hwang et al., 2021), 백내장 치료 (Xie et al., 2022) 등 다양한 기능이 증명되었다. 또한, 냉이의 여러 부위를 활용하여 대사체 프로파일링이 진행되었으며, 이를 통해 냉이에서 페놀류, 플라보노이드류 등 다양한 성분을 확인하였다 (Grosso et al., 2011; Cha et al., 2017; Lan et al., 2017; Peng et al., 2019).
나고야 의정서의 발효로 인해 국내 생물자원의 활용이 더욱 중요해진 지금, 식물이 함유하고 있는 다양한 기능성 성분에 대한 효능 연구가 이뤄지면서, 인류가 오랫동안 이용해 온 식물 자원들이 많은 관심을 받고 있다 (Choi et al., 2016).
그러나 냉이의 약리학적 특성 및 냉이 함유 대사물질에 대한 연구는 정리되어 있지만, 유전체 등 오믹스 정보를 함께 정리한 문헌은 아직 없다. 따라서 냉이의 유전체, 전사체, 약리학적 특성 및 냉이에서 발견된 대사물질 등 현재까지 진행된 연구를 함께 정리하여, 이를 토대로 냉이의 기능성 작물로써 활용 가치를 향상시킬 수 있는 육종의 방향을 설정하는 데 기여하고자 한다.
재료 및 방법
문헌 조사를 통해 지금까지 이뤄진 냉이의 오믹스 (유전체, 전사체, 대사체) 연구, 다양한 약리학적 특성과 대사체 프로파일링을 중심으로 연구 현황을 정리하였다.
또한 냉이에 함유된 대사물질로 잘 알려진 콜린 (choline), 글루코시놀레이트 (glucosinolate)의 대사경로는 아직 밝혀지지 않아, 같은 십자화과 작물이며 모델 플랜트인 애기장대에서의 대사경로를 정리하였다.
그림은 유전체의 기원 및 주요 대사물질 생합성 경로를 도식화하였으며, 표는 지금까지 수행된 냉이의 약리학적 특성 연구 결과 및 대사체 프로파일링 연구 결과를 정리하였다.
결과 및 고찰
1. 냉이의 식물학적 특성 및 분포
냉이 [C. bursa-pastoris (L.) Medik]는 십자화과 (Brassicaceae) 에 속하는 토종 식물이다. 월년생이며 뿌리가 얕고 40 ㎝ − 50 ㎝ 정도 자라고, 잎은 바닥에 붙어 사방으로 뻗어나가는 형태인 로제트형이다 (Kılıç, 2022).
빙하시대 이전 유라시아 대륙이 원산지이지만, 이후 이민자들에 의해 다른 대륙으로 전파되었고 현재는 유럽, 아시아, 아메리카, 오세아니아, 아프리카 모두에서 발견되며 전 세계적으로 분포한다 (Wesse et al., 2020).
이에 따라, 냉이는 다양한 이름을 가지고 있다. 영어로는 shepherd’s purse로 불리며 이외에도 shepherd’s scrip, shepherd’s sprout, lady’s purse, witches’ pouches, rattle pouches, case-weed, pickpocket, pick-purse, bindweed, pepper-and-salt, clapped pouch, sanguinary, mother’s heart, poor man’s pharmacetty 등 다양한 이름이 영어권 국가에서 사용된다. 아랍어로도 madakat el raee, kess et raee, sharbat el raee, guzman el raee, karmala 등 다양하게 불리며 이외에도 bourse de pasteur (프랑스어), hirtentasche (독일어) 등 다양한 이름이 존재한다 (Dar et al., 2021).
2. 냉이 유전체
냉이는 두 계통 사이의 교잡과 배수화에 의한 이질사배체 (allotetraploid)이다 (Douglas et al., 2015). 냉이의 유전체는 Capsella grandiflora/Capsella rubella 계통에서 유래한 A 하위유전체 (subgenome)와 Capsella orientalis 계통에서 기원한 B 하위유전체가 교잡이 일어나면서 자발적으로 배수화가 된 것으로 예상된다 (Bachmann et al., 2021) (Fig. 1). 또한, A 및 B 하위유전체는 독립적으로 유전되며, 냉이의 모계 조상은 C. orientalis 계통에서 나온 것으로 알려져 있다 (Hurka et al., 2012).
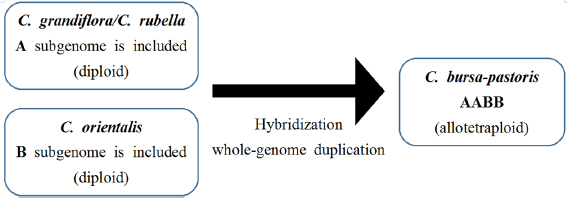
Origin of allotetraploid C. bursa-pastoris. C. bursa-pastoris originated from both A and B lineages, and experienced hybridization and whole-genome duplication.
냉이의 유전체를 Illumina HiSeq 및 MiSeq 플랫폼을 사용하여 분석하고, C. rubella의 유전체를 바탕으로 조립하였을 때, 최종 어셈블리는 8,362 개의 스캐폴드 (scaffold)로 구성되며 유전체 크기는 268.7 Mbp로 확인되었다 (Kasianov et al., 2017).
분석 결과에 따르면 A 하위유전체 또는 B 하위유전체에 할당된 대부분의 스캐폴드에서는 다른 하위유전체의 유전자가 거의 없어, 이를 통해 하위유전체 간의 재결합이 없거나 매우 적다는 것을 알 수 있었다. 또한 RNA-seq 데이터와 애기장대 및 C. rubella의 유전자 모델을 기반으로 53,502 개의 단백질 코딩 유전자가 예측되었으며, 그중 45,591 개는 상동유전자 (gene ontology)를 사용하여 유전자 정보를 체계적으로 정리할 수 있었다.
미토콘드리아 유전체는 PacBio SMRT 시퀀싱 기술을 이용하여 조립되었다 (Omelchenko et al., 2020). 길이는 287,799 bp이며 32 개의 단백질 코딩 유전자, 3 개의 ribosomal RNA (rRNA), 15 개의 아미노산에 해당하는 25 개의 transfer RNA (tRNA) 및 8 개의 open reading frame (ORF)를 포함하고 있다. 또한, 미토콘드리아 염기 서열의 비교를 통해 C. rubella와 C. orientalis 중에서, C. orientalis가 모계 조상 종이 될 수 있음을 시사한다.
냉이의 배아 발달 기간의 대규모 유전자 발현을 complementary DNA amplified fragment length polymorphism (cDNA-AFLP) 기술을 통해 분석한 결과, 231 개의 차별적으로 발현되는 유전자를 분리하였다 (Tao and Wang, 2012).
이를 통해 분리된 전사체 유래 단편 (transcript-derived fragments, TDFs)은 애기장대 혹은 다른 식물의 염기 서열과 유사하였고, 128 개는 기능이 알려진 유전자와 상동성을 보여 전사, 대사, 질병 방어 및 단백질 결합에 관여하는 13 개의 카테고리로 분류되었다. 상동성을 보이는 애기장대 유전자의 발현과 비교 시, 64 개는 유사한 발현 양상을 보였으나, 26 개의 발현 양상은 애기장대와 달랐다. 또한, reverse transcription polymerase chain reaction (RT-PCR)에 따르면 산화 스트레스 및 abscisic acid (ABA) 반응과 관련된 일부 유전자는 냉이의 배아 발생 시, 강하게 증가 되었다.
애기장대의 저온 유발 (cold-responsive, COR) 유전자인 AtCOR15a에 대한 상동유전자로, 내한성을 보이는 냉이의 CbCOR15a가 분리되었다 (Zhou et al., 2012). 조직 특이적 발현 패턴 분석과 CbCOR15a 프로모터의 특성 분석을 통해 CbCOR15a의 발현이 잎과 줄기뿐 아니라 뿌리에서도 추위에 의해 유도된다는 사실을 밝혔으며, CbCOR15a이 과발현된 형질전환 담배 식물체는 향상된 내한성을 보였다. 위 결과는 CbCOR15a가 냉이의 저온 반응에 관여하는 것을 보여준다.
냉이의 유전체 분석과 더불어 배수체인 냉이의 유전체 진화의 관점에서 유전자 발현의 다양성을 알아보기 위해 냉이의 꽃, 씨앗 등 10 개의 다른 기관과 발달 단계를 조사했으며, 저온 스트레스 조건 아래에서의 유전자 발현 변화 분석을 중점으로 냉이에서 ribonucleic acid sequencing (RNA-seq)을 수행하였다 (Kasianov et al., 2017).
A와 B 하위유전체에서 발현되는 유전자의 수나 전체적인 발현 양상은 높은 유사성을 보였으나, 서로 다른 발현 패턴을 보이는 일부 쌍이 존재하였다. 이는 배수체가 될 때, 하위 유전체들의 프로모터 부분의 변화가 차별적 발현 양상의 중요한 요인으로, 빛에 대한 반응을 비롯한 많은 발달 과정과 연관되어 있다.
예를 들어, 빛 [phytochrome-interacting factor 3 (PIF3)}, elongated hypocotyl (HY5)] 및 저온 스트레스 반응 (C-repeat binding factors, CBF)에 의한 광합성 및 식물 발달 조절을 제어하는 전사 인자에 대한 여러 결합 부위의 변이에 기인하는 것으로 보인다. 이러한 발현 차이는 냉이가 다양한 환경조건에 적응하고 분포를 확장할 수 있게 해 주는 진화적으로 가치 있는 특성이라 추측된다. 위 데이터는 분석과 시각화 편의를 위해 온라인으로 공개되어 있다 (http://travadb.org/browse/Species=Cbp).
식물의 생존에 매우 중요한 종자의 2차 휴면을 조절하는 후성 유전적 과정이 냉이를 소재로 조사되었다 (Gomez-Cabellos et al., 2022). 휴면 억제제에 노출된 종자와 노출되지 않은 종자 간 전사체 분석을 통해 억제제에 노출된 종자에서 옥신 (auxin), 지베렐린 (gibberellic acid) 및 브라시노스테로이드 (brassinosteroid) 등 식물 호르몬의 생합성 유전자의 발현 감소와 SIN3-like (SNL) 유전자의 발현 증가를 확인하였으며, 이것은 발아 지연 및 2차 휴면성 증가를 설명할 수 있다. 또한, 2차 휴면의 깊이가 다른 종자의 전사체 분석은 식물 호르몬과 후성유전학적 조절이 2차 휴면 깊이의 차이를 제어하는데 중요한 역할을 한다는 것을 보여준다.
3. 냉이의 약리학적 특성
냉이에서 항염증, 항산화 등 다양한 약리학적 기능이 보고 되었으며 Table 1에 그 내용을 정리하였다.
그람 음성균의 외막 성분인 lipopolysaccharide (LPS)의 고농도 자극은 대식세포에서 염증 반응을 유도한다고 알려져 있다 (Jung et al., 2014).
LPS로 자극한 쥐 유래 대식세포인 RAW 264.7에 설포라판 (sulforaphane)이 함유된 냉이 추출물을 처리하면, 염증 관련 물질인 산화질소 (nitric oxide, NO), 사이토카인 (cytokines)과 prostaglandin E2 (PGE2)의 수치 감소와 유도성 NO 합성효소 (inducible NO synthase, iNOS)와 cyclooxygenase 2 (COX-2) 발현을 감소시키는 등 항염증 활성을 확인하였다 (Choi et al., 2014). 또한, 냉이의 에탄올 추출물의 폴리페놀 성분이 LPS로 자극된 대식세포의 NO, PGE2, tumor necrosis factor-α (TNF-α), interleukin 6 (IL-6)의 생성을 억제하는 항염증 활성을 가지고 있음을 보고 한 바 있다 (Peng et al., 2019).
냉이의 전체 식물을 이용한 메탄올 추출물에서 발견된 페놀배당체의 항염증 활성이 보고되었다 (Cha et al., 2017). 위 연구에서는 LPS로 염증 반응이 유도된 쥐 소교세포 BV-2에서 NO의 생성을 50% 억제하는 농도값 (IC50)이 페놀성 배당체인 (+)-pinoresinol-β-D-glucoside은 17.80 µM, β-hydroxy-propiovanillone 3-O-β-D-glucopyranoside은 27.91 µM로서 항염증 효과를 보였으며 (Cha et al., 2017), 루테올린 (luteolin)은 9.70 µM로 NO 생산에 대한 강력한 억제 효과를 나타냈다 (Cha et al., 2018).
카라기난과 알부민을 이용해 쥐의 발에 부종을 유발하여 냉이 지상부의 에틸아세테이트 추출물 처리 시에도 항염증 활성을 보였으며, 이는 표준 의약품 (standard drug)인 루테올린보다 더 효과적인 항염증 작용을 보여준다 (Lan et al., 2017).
냉이의 항산화 활성을 조사하기 위해 냉이 지상부에서 메탄올 및 메탄올 : 물 (1 : 1) 혼합물을 사용해 추출한 추출물이 산화 스트레스와 관련된 라디칼인 DPPH· (2,2-diphenyl-1-picrylhydrazyl), O2·- (superoxide radical), LOO· (lipid peroxy radical), ·NO (nitric oxide radical) 소거능이 조사되었다 (Grosso et al., 2011).
추출물별로 앞의 네 가지 라디칼이 억제되는 정도가 달랐는데, 메탄올:물 추출물은 DPPH·, O2·-, ·NO 소거에 더 효과적이었으며 메탄올 추출물은 LOO· 소거에 더 효과적이었다.
또한 비생물적 요인이 냉이의 항산화 활성에 영향을 주는지에 대한 연구가 이루어졌다 (Neagu et al., 2019). 서로 다른 두 지역에서 냉이를 채취하여 항산화 활성 조사 방법인 DPPH, ABTS [2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)] 분석을 통해 항산화 활성을 비교했을 때, 지역별로 유의미한 차이가 나타났다. 또한 항산화 활성 값은 총 페놀류 함량 값과 양의 상관관계를 나타냈다.
그러나 냉이 지상부로부터 추출한 에센셜 오일의 항산화 활성을 확인하기 위해 DPPH 소거능을 조사한 한 연구에서는 에센셜 오일의 항산화 활성이 좋지 않았다 (Kamali et al., 2015).
냉이 지상부의 에탄올 추출물을 쥐의 복강 내 주사 (0.14 g/㎏/일)로 치료하면, 쥐의 피하조직에 접종된 에를리히 종양 세포 (ehrlich tumor cell) 고형 성장을 50% − 80% 정도 억제하였다 (Kuroda et al., 1976). 항종양 작용을 하는 활성 성분을 분리, 동정하기 위한 실험을 통해 푸마르산이 결정형으로 분리되었으며, 10 ㎎/㎏/day의 용량에서 에를리히 고형 종양의 성장을 억제하는 데 효과적이었다.
메탄올 추출물을 인간 구강암 세포인 human squamous carcinoma cell line 2 (HSC-2) 세포에 처리하였을 때, 추출물은 농도 의존적으로 성장 억제와 세포 사멸을 유도하였다 (Lee et al., 2013). 또한 추출물은 specificity protein 1 (Sp1) 단백질 발현을 현저히 감소시켰는데, Sp1의 녹아웃이 성장 억제 및 전체 poly (ADP-ribose) polymerase (PARP) 발현의 감소를 초래한다는 것을 확인하였으며, 이를 통해 Sp1 단백질의 현저한 감소가 세포 성장을 억제하고 세포 사멸을 유도할 수 있음을 나타냈다.
냉이는 자궁의 근육에 영향을 주어 수축을 촉진하는 효과가 있다고 알려져 있다 (Livdans-Forret et al., 2007).
분만 후 출혈 (postpartum hemorrhage, PPH)은 산모 사망이 가장 많이 발생하는 아프리카와 아시아에서 산모 사망의 3분의 1 이상이 PPH로 인해 일어난다 (Fawole et al., 2010). 또한 사망으로 이어지지 않더라도 산모에게 돌이킬 수 없는 합병증을 초래할 수 있다. 따라서, 냉이의 하이드로알코올 추출물이 초기 PPH에 미치는 영향이 확인되었다 (Ghalandari et al., 2017). 한 그룹에서 냉이의 하이드로알코올 추출물이 첨가된 옥시토신을 투여하고 대조군 그룹에는 단순하게 옥시토신만을 투여한 후 두 그룹의 산후 출혈량을 비교하였을 때, 냉이 추출물이 첨가된 옥시토신을 투여한 그룹의 출혈량 감소가 유의하게 더 컸다.
또한 냉이의 하이드로알코올 추출물이 여성의 삶의 질을 떨어뜨리고 빈혈의 주요 원인 중 하나인 과다 월경 출혈 (heavy menstrual bleeding, HMB)에 미치는 영향이 확인되었다 (Naafe et al., 2018). 한 그룹에서 냉이의 하이드로알코올 추출물과 메페남산 (mefenamic acid)을 동시에 복용하고 대조군 그룹에는 단순하게 메페남산만을 복용한 후 그 결과를 비교하였을 때, 냉이 추출물을 함께 복용한 그룹에서 출혈량이 훨씬 더 유의하게 감소하였다.
전 세계적으로 2,400만 명의 사람들이 알츠하이머 (Alzheimer’s disease, AD)를 앓고 있으며 AChE 억제제를 사용하는 것은 알츠하이머 치료 방법 중 하나이다. 냉이의 메탄올 및 메탄올 : 물 추출물은 높은 AChE 억제 능력을 나타내며 냉이의 질병치료에 관련된 중요한 생물학적 특성을 알 수 있었다 (Grosso et al., 2011).
또한 터키의 10 종의 식용 식물을 다양한 용매 (핵산, 에탄올, 물)를 이용하여 추출한 추출물의 콜린 에스테라아제 억제능력이 조사되었는데, 그중 냉이의 핵산 추출물의 IC50이 7.24 ㎍/㎖를 나타내며 AChE에 대해 가장 강력한 억제 능력을 보여주었다 (Kurt et al., 2018).
냉이의 에탄올 추출물이 간 내 지질 대사에 미치는 영향에 대해서 조사되었다 (Choi et al., 2017).
추출물은 히스톤 아세틸전이효소 (histone acetyltransferase, HAT)를 억제하였으며, 이것은 간의 지방 증가를 완화시킬 수 있다. 또한 추출물은 올레산에 의한 지질 축적을 완화하였으며, 이러한 결과는 냉이가 비알콜성 지방간 질환의 예방 및 치료에 사용될 수 있음을 시사한다.
냉이 에탄올 추출물은 비만 쥐에서 pro-protein convertase subtilisin/kexin type 9 (PCSK9) 유전자 발현을 감소시킴으로써 혈청 총 콜레스테롤 및 low-density lipoprotein (LDL) 콜레스테롤 수준을 유의하게 감소시켰다 (Hwang et al., 2021).
냉이 추출물 1 ㎏ 당, 17.5 ㎎의 이카리틴 (icaritin)이 함유되어 있는데, 이 물질은 전사인자 sterol regulatory element binding protein 2 (SREBP2)와 hepatocyte nuclear factor-1α (HNF-1α)를 억제하여 세포 내 PCSK9과 LDL receptor (LDLR) 수준을 감소시켰다. 따라서 이카리틴은 냉이 추출물에 의한 PCSK9 억제에 기여하며 고콜레스테롤혈증의 치료 대안으로 활용될 수 있다.
냉이 추출물이 백내장에 미치는 영향이 조사되었다 (Xie et al., 2022). Selenite를 실험 쥐의 눈에 투여하여 쥐에게 백내장을 유발한 후, 냉이 추출물을 투여하였더니, 냉이 추출물의 플라보노이드는 B-cell lymphoma-2 (Bcl2), B-cell lymphoma-2-associated X protein (Bax), cysteinyl aspartate specific proteinase-3 (caspase 3) 단백질의 발현을 조절하여 수정체 혼탁을 감소시키고 수정체의 산화 스트레스를 억제하며 수정체상피 세포의 세포 사멸을 억제하였다.
4. 약리학적 사용을 제외한 기타 활용
부식은 금속을 다룰 때 흔히 일어나며 금속의 부식을 조절하는 과정은 높은 비용이 들어간다. 따라서 가격이 싸면서도 환경적으로 안전하고 효율성이 뛰어난 부식 억제제를 천연 제품에서 찾으려는 노력이 늘고 있다. 냉이 에탄올 추출물은 간단하고 편리한 방법으로 추출될 수 있으며, 탄소강 부식을 효과적으로 억제하는 친환경 억제제로 사용될 수 있음이 입증되었다 (Hu et al., 2015).
냉이는 환경의 오염도를 확인할 수 있는 중금속의 바이오모니터로써 테스트되었다 (Aksoy et al., 1999). 토양 샘플과 냉이의 잎에서 중금속의 농도를 측정한 결과, 도시화가 진행 된 지역일수록 냉이 잎의 중금속의 농도가 더 높아졌으며, 냉이는 총 네 가지 중금속 (철, 카드뮴, 아연, 구리)에 대해서 모니터링이 가능하였다. 또한, 냉이는 오염에 대한 도시 지역에서의 단기적인 변화를 모니터링하는 데 특히 유용한 바이오모니터로 밝혀졌다.
5. 냉이에서 발견되는 화합물
다양한 기능을 보유하고 있는 냉이의 성분을 조사하기 위해 많은 연구가 이루어졌다. 냉이에 함유된 다양한 물질을 알기 위해서 주로 페놀 및 플라보노이드류의 대사체 프로파일링이 진행되었으며, 이외에도 황 화합물, 터펜류 등 다양한 물질이 조사되었다. 추출물은 다양한 용매를 통해 추출되었으며, 식물체 전체, 잎, 종자 등 다양한 부위에서 추출물을 추출하였으나 주로 냉이의 지상부가 사용되었다.
냉이의 지상부에서 황산을 이용하여 추출한 냉이 추출물을 high performance liquid chromatography (HPLC)를 통해 분석한 결과 oxalic acid 등 6 종의 유기산을 확인하였으며, 메탄올과 메탄올 : 물 혼합물을 이용한 추출물에서 glutamic acid등 18 종의 다양한 아미노산이 발견되었다 (Grosso et al., 2011).
또한 KOH 메탄올 용액을 용매로 하여, 지방산 9 종과 스테롤 9 종을 확인하였다 (Grosso et al., 2011). 그리고, 에틸아세테이트를 이용한 추출물에서는 뉴클레오티드 adenosine, uridine을 발견할 수 있었으며 (Lan et al., 2017), 벤젠을 용매로 한 추출물에서는 monoacylglycerols 등 5 종의 지질류가 조사되었다 (Bekker et al., 2002; Table 2).
냉이의 지상부에서 80% 메탄올을 용매로 한 추출물을 HPLC로 분석 결과, 7 종의 페놀류가 발견되었다 (Cha et al., 2017). 또한, 메탄올 추출물, 메탄올 및 물 1 : 1 혼합 추출물을 HPLC로 분석 결과, quercetin-6-C-glucoside 등 5 종의 플라보노이드가 발견되었으며 (Grosso et al., 2011), 에탄올 추출물을 HPLC로 분석한 결과 quercetin, icaritin 등 9 종의 플라보노이드가 발견되었다 (Ma et al., 2016). 냉이 에틸아세테이트 추출물을 HPLC로 분석하였더니 두 종의 플라보노이드가 발견되었다 (Lan et al., 2017).
냉이 식물 전체에서 추출한 에탄올 추출물이 ultra performance liquid chromatography (UPLC)를 통해 분석되었는데, 다양한 페놀류 물질 7 종 및 플라보노이드류 물질 16 종이 확인되었다 (Peng et al., 2019; Table 3).
냉이 전체 식물체에서 DMSO로 추출한 추출물을 liquid chromatography with tandem mass spectrometry (LC-MS/MS)로 분석한 결과, 십자화과 식물에 주로 함유된 것으로 잘 알려진 황 화합물인 글루코시놀레이트 16 종이 확인되었다 (Czerniawski et al., 2021).
냉이의 지상부에서 80% 메탄올을 이용해 추출한 추출물을 HPLC를 통해 분석하였더니 황 화합물 3 종을 관찰할 수 있었으며, 냉이 지상부에서 추출한 에탄올 추출물을 LC-MS/MS로 분석하여 10 종의 세스퀴테르펜 (sesquiterpene)을 확인하였다 (Ma et al., 2018).
냉이의 씨앗에서도 여러 물질이 발견되었다. 70% 에탄올로 추출한 추출물을 HPLC를 이용하여 분석하였더니 황 화합물 4 종을 발견하였다 (Wei et al., 2022). 또한 메탄올 추출물을 LC-MS/MS로 분석하여 주로 십자화과 작물에 많이 함유된 물질인 설포라판 (sulforaphane)을 확인하였다 (Hur et al., 2013; Table 4).
6. 냉이의 주요 대사물질 생합성 경로
콜린은 냉이에 함유된 것으로 잘 알려진 물질 중 하나이며 (Khare 2007; Al-Snafi, 2015), 모든 세포막에 필수적인 인지질을 만들고 신경전달물질을 합성하는 등 신체에서 다양한 역할을 한다 (Zeisel and da Costa, 2009). 그리고 임신과 수유중 산모에서 태아로 콜린의 이동이 많아 모체 혈장의 콜린이 고갈될 수 있어 임산부의 임신과 수유기에는 콜린 보충이 특히 중요한 물질이며, 산모가 임신 중 콜린을 보충하는 것은 신생아의 신경 건강 및 인지능력에 장기적으로 유익한 효과가 나타나는 등 콜린의 중요한 약리학적 기능이 많이 보고되었다 (Wong-Goodrich et al., 2008; Leermakers et al., 2015).
냉이에서 콜린의 함량 및 생합성 경로는 밝혀지지 않았다. 그러나 냉이와 같은 십자화과의 모델 식물인 애기장대의 잎에서 1.5 ± 0.3 µ㏖/g의 콜린이 발견되었으며 (Hayashi et al., 1997), 콜린의 생합성 경로 역시 잘 알려져 있다 (Kwon et al., 2012). 콜린은 진핵생물 세포막의 주요 인지질인 phosphatidylethanolamine (PE)와 phosphatidylcholine (PC)의 합성과 관련이 있다. 먼저 세린 (serine)에서 세린 탈탄산효소에 의해 에탄올아민 (ethanolamine, Etn)이 생성된다. 이후 Etn에서 세 번의 메틸화를 거쳐 콜린이 생성될 수 있으며, 이것은 동물 세포에서는 일어나지 않는다 (Rhodes and Hanson, 1993). 대부분의 진핵생물에서, Etn과 콜린에서부터 각각 PE와 PC를 생합성하며 이러한 병렬 구조의 경로를 ‘Kennedy pathway’라고 한다 (Kwon et al., 2012; Fig. 2).
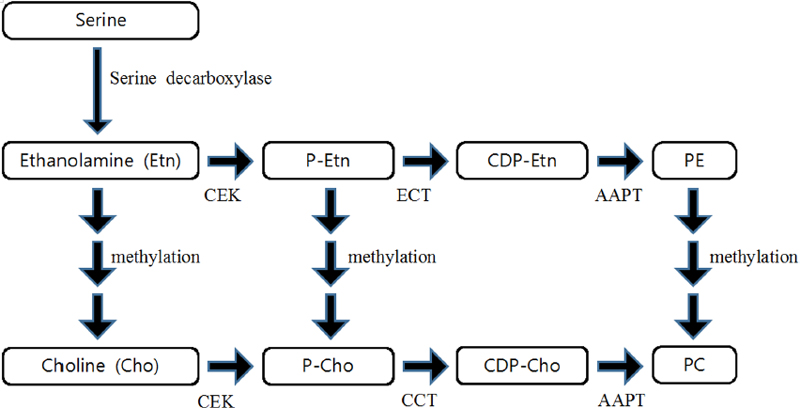
Biosynthetic pathway of phosphatidylethanolamine and phosphatidylcholine (Kennedy pathway).P-Etn; phosphoethanolamine, CDP-Etn; cytidine-diphosphoethanolamine, PE; phosphatidylethanolamine, P-Cho; phosphocholine, CDP-Cho; cytidine-diphosphocholine, PC; phosphatidylcholine, CEK; choline/ethanolamine kinase, ECT; ethanolamine cytidyltransferase, AAPT; aminoalcohol aminophosphotransferase, CCT; choline cytidyltransferase.
냉이 등 십자화과 식물에서 주로 발견되는 글루코시놀레이트는 황을 함유한 다양한 2차대사물질의 한 그룹으로 독특한 맛과 향을 내며, 식물 보호 및 사람의 암 예방 등 다양한 생물학적 기능을 나타낸다 (Grubb and Abel, 2006). 또한 십자화과 식물마다 다른 종류의 글루코시놀레이트가 합성되어 식물마다 다른 효능을 보이기 때문에, 독특한 향을 내는 냉이는 좋은 연구 대상이 될 수 있다.
냉이 종자에서 15.68 µ㏖/g의 글루코시놀레이트가 검출되었으며 (Chen et al., 2007), 글루코시놀레이트로부터 유래된 물질인 이소티오시아네이트 (isothiocyanate) 중 하나인 설포라판이 49.3±3.8 ㎍/g만큼 검출되었다 (Hur et al., 2013). 그러나 냉이에서 글루코시놀레이트 생합성 경로는 아직 밝혀지지 않았다. 또한 애기장대에서는 부위별 및 글루코시놀레이트 물질별 함량이 연구되었을 뿐만 아니라 (Petersen et al., 2002), 글루코시놀레이트의 생합성 경로 역시 잘 알려져 있다.
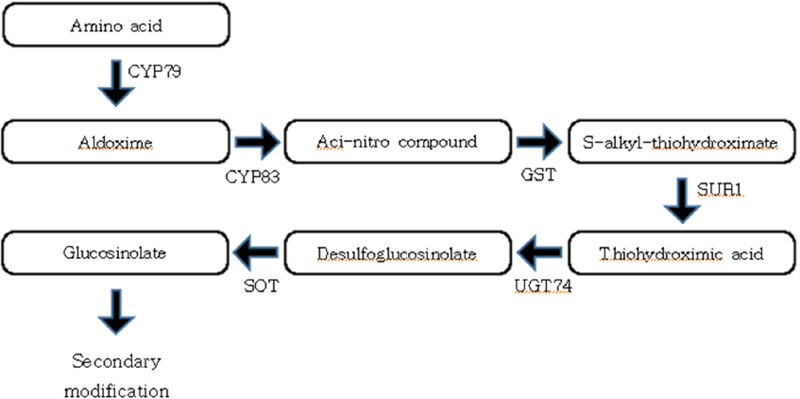
글루코시놀레이트는 전구체 아미노산에 따라 분류된다. 지방족 글루코시놀레이트는 메티오닌, 알라닌, 류신, 이소류신, 발린으로부터 만들어지고 방향족 글루코시놀레이트는 페닐알라닌, 티로신으로부터 만들어진다. 인돌 글루코시놀레이트는 트립토판에서 유래된다 (Halkier and Gershenzon, 2006). 그 중, 애기장대에서는 주로 메티오닌과 트립토판에서 글루코시놀레이트가 합성된다 (Sønderby et al., 2010).
지방족, 방향족, 인돌 글루코시놀레이트는 모두 공통된 핵심 글루코시놀레이트 생합경 경로를 거쳐 다양한 글루코시놀레이트가 생성된다 (Mikkelsen et al., 2004; Kitainda and Jez, 2021; Fig. 3). 다만 메티오닌에 의해 생성되는 지방족 글루코시놀레이트의 경우, 메티오닌이 핵심 생합성 경로로 넘어가기 전에 R그룹을 늘리는 지방족 사슬을 연장하는 과정을 거친다 (Kitainda and Jez, 2021).
7. 냉이 연구와 활용에 대한 전망
이른 봄에 소일거리로 채취해 계절 반찬으로 먹던 냉이는 세계 여러 나라의 고문헌에 등장하는 약용 식물이다. 냉이에서 항염증, 항암, 출혈 감소 등 다양한 약리학적 기능이 밝혀졌으며, 또한 금속 부식 억제 효과, 중금속의 바이오 모니터 효과 등 다양한 분야에서 활용될 수 있다는 것이 확인되었다.
냉이를 비롯한 자생식물은 별미를 가진 식재료와 대체의학의 재료로 널리 이용되고 있으나 최근에는 계절에 구애받지 않고 필요할 때 언제든 이용할 수 있는 식재료와 의학용 재료로의 활용성을 높이기 위한 연구들이 진행되고 있다. 예를 들면 방풍나물은 수경재배하여 실내에서 재배, 수확하여 사계절 내내 판매할 수 있도록 하거나 LED 등의 파장을 다양하게 조합하여 원하는 기능성 성분의 함량을 증대시키려는 연구가 활발히 진행되고 있고 실용화를 목전에 두고 있다 (Heo et al., 2013).
냉이의 유전체와 전사체, 대사체 연구도 진행되었는데, 주로 봄에 국한하여 채취할 수 있고 광이나 온도 등의 환경에 의해 식감과 맛이 달라지는 냉이의 경우에는 환경 스트레스에 반응하는 유전자가 많이 발달하였으며 플라보노이드류가 풍부하다.
임신과 수유기에 임산부들이 복용하여 태아의 신경 건강과 인지능력 발달에 유익한 영향을 주는 물질인 콜린은 냉이에 함유된 것으로 잘 알려진 물질 중 하나다. 그리고 항암 효과로 잘 알려진 물질인 글루코시놀레이트는 냉이를 비롯한 십자화과 식물에 주로 함유된 이차대사산물이다. 콜린, 글루코시놀레이트의 생합성 경로는 같은 십자화과 작물이면서 모델 식물인 애기장대를 통해 잘 밝혀져 있으나 배수체인 냉이의 효소와 유전자의 변이에 의해 함량부터 약리작용까지 달라질 수 있을 것이다.
토종 식물을 기능성 약용 작물로 활용하기 위해서 식물이 생육하는 환경 조건에 대한 이해와 함유하고있는 유용 기능성 성분의 합성에 대한 이해가 필요하다. 이러한 이해는 토종 식물이 가지는 약리적 효능을 극대화하여 건강 기능성 식품이나 의료용으로 사용할 수 있도록 재배 방법을 개선하거나 육종의 재료로 활용할 수 있을 것이다.
Acknowledgments
본 총설은 농촌진흥청 연구사업(과제번호: PJ01674901)의 지원에 의해 이루어진 결과로 이에 감사드립니다.
References
-
Aksoy A, Hale WHG, and Dixon JM. (1999). Capsella bursa-pastoris(L.) Medic. as a biomonitor of heavy metals. The Science of the Total Environment. 226:177-186.
[https://doi.org/10.1016/S0048-9697(98)00391-X]

- Al-Snafi AE. (2015). The chemical constituents and pharmacological effects of Capsella bursa-pastoris - A review. International Journal of Pharmacology and Toxicology. 5:76-81.
-
Bachmann JA, Tedder A, Fracassetti M, Steige KA, Lafon- Placette C, Köhler C and Slotte T. (2021). On the origin of the widespread self-compatible allotetraploid Capsella bursa- pastoris(Brassicaceae). Heredity. 127:124-134.
[https://doi.org/10.1038/s41437-021-00434-9]

-
Bekker NP, Ul'chenko NT and Glushenkova AI. (2002). Lipids of the aerial part of Capsella bursa-pastoris. Chemistry of Natural Compounds. 38:610-611.
[https://doi.org/10.1023/A:1022615627431]

-
Cha JM, Kim DH, Lee TH, Subedi L, Kim SY and Lee KR. (2018). Phytochemical constituents of Capsella bursa-pastoris and their anti-inflammatory activity. Natural Product Sciences. 24:132-138.
[https://doi.org/10.20307/nps.2018.24.2.132]

-
Cha JM, Suh WS, Lee TH, Subedi L, Kim SY and Lee KR. (2017). Phenolic glycosides from Capsella bursa-pastoris(L.) Medik and their anti-inflammatory activity. Molecules. 22:1023. https://www.mdpi.com/1420-3049/22/6/1023, (cited by 2023 Oct 6).
[https://doi.org/10.3390/molecules22061023]

-
Chen HF, Wang H and Li ZY. (2007). Production and genetic analysis of partial hybrids in intertribal crosses between Brassica species (B. rapa, B. napus) and Capsella bursa-pastoris. Plant Cell Reports. 26:1791-1800.
[https://doi.org/10.1007/s00299-007-0392-x]

-
Choi EY, Heo SI, Kwon YS and Kim MJ. (2016). Anti-oxidant activity and anti-inflammatory effects of Spiraea fritschiana Schneid extract. Korean Journal of Medicinal Crop Science. 24:31-37.
[https://doi.org/10.7783/KJMCS.2016.24.1.31]

-
Choi HK, Shin EJ, Park SJ, Hur HJ, Park JH, Chung MY, Kim MS and Hwang JT. (2017). Ethanol extract of Capsella bursa-pastoris improves hepatic steatosis through inhibition of histone acetyltransferase activity. Journal of Medicinal Food. 20:251-257.
[https://doi.org/10.1089/jmf.2016.3877]

- Choi HS, Kang EJ and Kim KH. (2006). Analyses of essential oil and headspace compositions of Capsella bursa-pastoris Medicus by SDE and SPME methods. Korean Journal of Food Preservation. 13:108-114.
-
Choi WJ, Kim SK, Park HK, Sohn UD and Kim W. (2014). Anti-inflammatory and anti-superbacterial properties of sulforaphane from shepherd's purse. Korean Journal of Physiology and Pharmacology. 18:33-39.
[https://doi.org/10.4196/kjpp.2014.18.1.33]

-
Czerniawski P, Piasecka A and Bednarek P. (2021). Evolutionary changes in the glucosinolate biosynthetic capacity in species representing Capsella, Camelina and Neslia genera. Phytochemistry. 181:112571. https://www.sciencedirect.com/science/article/abs/pii/S0031942220311869, (cited by 2023 Oct 6).
[https://doi.org/10.1016/j.phytochem.2020.112571]

-
Dar MA, Mir RH, Mohi-ud-din R, Mir PA, Masoodi MH, Akbar S, Mir SR and Sawhney G. (2021). Capsella Bursa-pastoris(L.) Medic: An insight into its pharmacology, expository traditional uses and extensive phytochemistry. Current Traditional Medicine. 7:168-179.
[https://doi.org/10.2174/2215083806666200203142107]

-
Defelice M. (2001). Shepherd's-purse, Capsella bursa-pastoris (L.) Medic. Weed Technology. 15:892-895.
[https://doi.org/10.1614/0890-037X(2001)015[0892:SSPCBP]2.0.CO;2]

-
Douglas GM, Gos G, Steige KA, Salcedo A, Holm K, Josephs EB, Arunkumar R, Ågren JA, Hazzouri KM, Wang W, Platts AE, Williamson RJ, Neuffer B, Lascoux M, Slotte T and Wright SI. (2015). Hybrid origins and the earliest stages of diploidization in the highly successful recent polyploid Capsella bursa-pastoris. Proceedings of the National Academy of Sciences. 112:2806-2811.
[https://doi.org/10.1073/pnas.1412277112]

-
Fawole AO, Sotiloye OS, Hunyinbo KI, Umezulike AC, Okunlola MA, Adekanle DA, Osamor J, Adeyanju O, Olowookere OO, Adekunle AO, Singata M, Mangesi L and Hofmeyr GJ. (2010). A doubleblind, randomized, placebo-controlled trial of misoprostol and routine uterotonics for the prevention of postpartum hemorrhage. International Journal of Gynecology and Obstetrics. 112:107-111.
[https://doi.org/10.1016/j.ijgo.2010.08.023]

-
Ghalandari S, Kariman N, Sheikhan Z, Mojab F, Mirzaei M and Shahrahmani H. (2017). Effect of hydroalcoholic extract of Capsella bursa pastoris on early postpartum hemorrhage: A clinical trial study. The Journal of Alternative and Complementary Medicine. 23:794-799.
[https://doi.org/10.1089/acm.2017.0095]

-
Gomez-Cabellos S, Toorop PE, Fernández-Pascual E, Iannetta PPM, Pritchard HW and Visscher AM. (2022). (Epi)genetic control of secondary seed dormancy depth and germination in Capsella bursa-pastoris. Seed Science Research. 32:200-221.
[https://doi.org/10.1017/S0960258522000265]

-
Grosso C, Vinholes J, Silva LR, Pinho PGd, Gonçalves RF, Valentão P, Jäger AK and Andrade PB. (2011). Chemical composition and biological screening of Capsella bursa-pastoris. Revista Brasileira de Farmacognosia. 21:635-643.
[https://doi.org/10.1590/S0102-695X2011005000107]

-
Grubb CD and Abel S. (2006). Glucosinolate metabolism and its control. Trends in Plant Science. 11:89-100.
[https://doi.org/10.1016/j.tplants.2005.12.006]

-
Halkier BA and Gershenzon J. (2006). Biology and biochemistry of glucosinolates. Annual Review of Plant Biology. 57:303-333.
[https://doi.org/10.1146/annurev.arplant.57.032905.105228]

-
Hayashi H, Alia, Mustardy L, Deshnium P, Ida M and Murata N. (1997). Transformation of Arabidopsis thaliana with the codA gene for choline oxidase; accumulation of glycinebetaine and enhanced tolerance to salt and cold stress. The Plant Journal 12:133-142
[https://doi.org/10.1046/j.1365-313X.1997.12010133.x]

-
Heo JW, Kim DE, Han KS and Kim SJ. (2013). Effect of light-quality control on growth of Ledebouriella seseloides grown in plant factory of an artificial light type. Korean Journal of Environmental Agriculture. 32:193-200.
[https://doi.org/10.5338/KJEA.2013.32.3.193]

-
Hu Q, Qiu Y, Zhang G and Guo X. (2015). Capsella bursa-pastoris extract as an eco-friendly inhibitor on the corrosion of Q235 carbon steels in 1 mol·ℓ−1 hydrochloric acid. Chinese Journal of Chemical Engineering. 23:1408-1415.
[https://doi.org/10.1016/j.cjche.2015.05.002]

-
Hur J, Yoo M, Shin DB and Lee S. (2013). Inhibition of nitric oxide production corresponds to the sulforaphane content in Korean sheperd’s purse(Capsella bursa-pastoris) and related species in BV-2 cell. Food Science and Biotechnology. 22:1085-1089.
[https://doi.org/10.1007/s10068-013-0187-5]

-
Hurka H, Frieson N, German DA, Franzke A and Neuffer B. (2012). 'Missing link' species Capsella orientalis and Capsella thracica elucidate evolution of model plant genus Capsella (Brassicaceae). Molecular Ecology. 21:1223-1238.
[https://doi.org/10.1111/j.1365-294X.2012.05460.x]

-
Hwang JT, Choi E, Choi HK, Park JH and Chung MY. (2021). The cholesterol-lowering effect of Capsella Bursa-Pastoris is mediated via SREBP2 and HNF-1α-Regulated PCSK9 Inhibition in obese mice and HepG2 cells. Foods. 10:408. https://www.mdpi.com/2304-8158/10/2/408, (cited by 2023 Sep 15).
[https://doi.org/10.3390/foods10020408]

-
Jung HK, Kang BM, Jang JH, Ahn BK, Yeo JH, Jung WS, Cho JH, Kuk YI, Hyun KH and Cho HW. (2014). Inhibitory effect of Alopecurus aequalis Sobol ethanol extracts on LPS-induced inflammatory response in RAW 264.7 cells. Korean Journal of Medicinal Crop Science. 22:98-104.
[https://doi.org/10.7783/KJMCS.2014.22.2.98]

- Kamali H, Sani TA, Feyzi P and Mohammadi A. (2015). Chemical composition and antioxidant activity from essential oil of Capsella bursa-pastoris. International Journal of PharmTech Research. 8:1-4.
-
Kasianov AS, Klepikova AV, Kulakovskiy IV, Gerasimov ES, Fedotova AV, Besedina EG, Kondrashov AS, Logacheva MD and Penin AA. (2017). High-quality genome assembly of Capsella bursa-pastoris reveals asymmetry of regulatory elements at early stages of polyploid genome evolution. The Plant Journal. 91:278-291.
[https://doi.org/10.1111/tpj.13563]

-
Khare CP. (2007). Indian medicinal plants: An illustrated dictionary. Springer Science and Business Media. New York, NY, USA. p.119.
[https://doi.org/10.1007/978-0-387-70638-2]

-
Kılıç CS. (2022). Capsella bursa-pastoris(L.) Medik. In Dereli FTG. et al. (ed.). Novel drug targets with traditional herbal medicines: Scientific and clinical evidence. Springer Nature. Berlin, Germany. p.79-93.
[https://doi.org/10.1007/978-3-031-07753-1_6]

-
Kitainda V and Jez JM. (2021). Structural studies of aliphatic glucosinolate chain-elongation enzymes. Antioxidants. 10:1500. https://www.mdpi.com/2076-3921/10/9/1500, (cited by 2023 Oct 6).
[https://doi.org/10.3390/antiox10091500]

-
Kuroda K and Takagi K. (1968). Physiologically active substance in Capsella bursa-pastoris. Nature. 220:707-708.
[https://doi.org/10.1038/220707a0]

- Kuroda K, Akao M, Kanisawa M and Miyaki K. (1976). Inhibitory effect of Capsella bursa-pastoris extract on growth of Ehrlich solid tumor in mice. Cancer Research. 36:1900-1903.
- Kurt BZ, Gazioğlu I, Sevgi E and Sönmez F. (2018). Anticholinesterase, antioxidant, antiaflatoxigenic activities of ten edible wild plants from Ordu area, Turkey. Iranian Journal of Pharmaceutical Research. 17:1047-1056.
-
Kwon Y, Yu SI., Lee H, Yim JH, Zhu JK and Lee BH. (2012). Arabidopsis serine decarboxylase mutants implicate the roles of ethanolamine in plant growth and development. International Journal of Molecular Sciences. 13:3176-3188.
[https://doi.org/10.3390/ijms13033176]

-
Lan X, Qing-Hu W, Bai-yin-mu-qi-er B and A-gu-la B. (2017). Chemical composition and anti-inflammatory effects of the EtOAc extract from Capsella bursa-pastoris(L.) Medic. African Journal of Pharmacy and Pharmacology. 11:186-190.
[https://doi.org/10.5897/AJPP2017.4762]

-
Lee KE, Shin JA, Hong IS, Cho NP and Cho SD. (2013). Effect of methanol extracts of Cnidium officinale Makino and Capsella bursa-pastoris on the apoptosis of HSC-2 human oral cancer cells. Experimental and Therapeutic Medicine. 5:789-792.
[https://doi.org/10.3892/etm.2012.871]

-
Leermakers ETM, Moreira EM, Kiefte-de Jong JC, Darweesh SKL, Visser T, Voortman T, Bautista PK, Chowdhury R, Gorman D, Bramer WM, Felix JF and Franco OH. (2015). Effects of choline on health across the life course: A systematic review. Nutrition Reviews. 73:500-522.
[https://doi.org/10.1093/nutrit/nuv010]

- Livdans-Forret AB, Harvey PJ and Larkin-Thier SM. (2007). Menorrhagia: A synopsis of management focusing on herbal and nutritional supplements, and chiropractic. The Journal of the Canadian Chiropractic Association. 51:235-246.
-
Ma Q, Guo Y, Wei R, Sang Z, Liu W, Gao L and Liu T. (2016). Flavonoids from Capsella bursa-pastoris and their hepatoprotective activities in vitro. Revista Brasileira de Farmacognosia. 26:710-713.
[https://doi.org/10.1016/j.bjp.2016.06.006]

-
Ma Q, Wei R and Cao Z. (2018). Neuroprotective sesquiterpenes from Capsella bursa-pastoris. Chemistry of Natural Compounds. 54:1004-1008.
[https://doi.org/10.1007/s10600-018-2536-3]

-
Mikkelsen MD, Naur P and Halkier BA. (2004). Arabidopsis mutants in the C-S lyase of glucosinolate biosynthesis establish a critical role for indole-3-acetaldoxime in auxin homeostasis. The Plant Journal. 37:770-777.
[https://doi.org/10.1111/j.1365-313X.2004.02002.x]

-
Naafe M, Kariman N, Keshavarz Z, Khademi N, Mojab F and Mohammadbeigi A. (2018). Effect of hydroalcoholic extracts of Capsella bursa-pastoris on heavy menstrual bleeding: A randomized clinical trial. The Journal of Alternative and Complementary Medicine. 24:694-700.
[https://doi.org/10.1089/acm.2017.0267]

-
Neagu E, Paun G, Ungureanu O and Radu GL. (2019). Antioxidant activity and phenolics content of Capcella bursa- pastoris and Marrubium vulgare depending on environmental factors. Environmental Engineering and Management Journal. 18:1553-1560.
[https://doi.org/10.30638/eemj.2019.146]

-
Omelchenko DO, Makarenko MS, Kasianov AS, Schelkunov MI, Logacheva MD and Penin AA. (2020). Assembly and analysis of the complete mitochondrial genome of Capsella bursa-pastoris. Plants. 9:469. https://www.mdpi.com/2223-7747/9/4/469, (cited by 2023 Sep 15).
[https://doi.org/10.3390/plants9040469]

-
Peng J, Hu T, Li J, Du J, Zhu K, Cheng B and Li K. (2019). Shepherd's purse polyphenols exert its anti-inflammatory and antioxidative effects associated with suppressing MAPK and NF-κB pathways and heme oxygenase-1 activation. Oxidative Medicine and Cellular Longevity. 2019:7202695. https://www.hindawi.com/journals/omcl/2019/7202695/, (cited by 2023 Sep 15).
[https://doi.org/10.1155/2019/7202695]

-
Petersen B, Chen S, Hansen C, Olsen C and Halkier B. (2002). Composition and content of glucosinolates in developing Arabidopsis thaliana. Planta. 214:562-571.
[https://doi.org/10.1007/s004250100659]

- Qayyum A, Riaz I, Ahmad N and Bibi Y. (2018). Pharmacological and nutritional value of Capsella bursa-pastoris. A review. Zeitschrift für Arznei- und Gewürzpflanzen. 23:45-49.
-
Rhodes D and Hanson AD. (1993). Quaternary ammonium and tertiary sulfonium compounds in higher plants. Annual Review of Plant Physiology and Plant Molecular Biology 44:357-384.
[https://doi.org/10.1146/annurev.pp.44.060193.002041]

-
Sønderby IE, Geu-Flores F and Halkier BA. (2010). Biosynthesis of glucosinolates – gene discovery and beyond. Trends in Plant Science. 15:283-290.
[https://doi.org/10.1016/j.tplants.2010.02.005]

-
Tao P and Wang JB. (2012). Identification and characterization of transcripts differentially expressed during embryogenesis in Capsella bursa-pastoris. Biologia Plantarum. 56:415-421.
[https://doi.org/10.1007/s10535-012-0058-6]

-
Wei ZZ, Zhou TQ, Xia ZM, Liu SF, Li M, Zhang GJ, Tian Y, Li B and Wang L. (2022). Four organosulfur compounds from the seeds of Capsella bursa-pastoris and their anti-inflammatory activities. Natural Product Research. 37:2688-2696.
[https://doi.org/10.1080/14786419.2022.2130307]

-
Wesse C, Welk E, Hurka H and Neuffer B. (2020). Geographical pattern of genetic diversity in Capsella bursa-pastoris (Brassicaceae)—A global perspective. Ecology and Evolution. 11:199-213.
[https://doi.org/10.1002/ece3.7010]

-
Wong-Goodrich SJE, Glenn MJ, Mellott TJ, Blusztajn JK, Meck WH and Williams CL. (2008). Spatial memory and hippocampal plasticity are differentially sensitive to the availability of choline in adulthood as a function of choline supply in utero. Brain Research. 1237:153-166.
[https://doi.org/10.1016/j.brainres.2008.08.074]

- Xie LK, Xu XJ, Wu X, Wang MJ, Gao CF, Wang DM, Ren SM, Pan YN and Liu XQ. (2022). Capsella bursa-pastoris(L.) Medic. extract alleviate cataract development by regulating the mitochondrial apoptotic pathway of the lens epithelial cells. Journal of Ethnopharmacol. 284:114783. https://www.sciencedirect.com/science/article/pii/S0378874121010138?casa_token=QCczv9JJ0XcAAAAA:1vR_QflQj59jWQxqWePb_SIkRPHpp266V5yMNUzud-2fthH9RR86BSS8tlaIDuVGo5KqJJ7-yTA, (cited by 2023 Sep 15).
-
Zeisel SH and da Costa KA. (2009). Choline: An essential nutrient for public health. Nutrition Reviews. 67:615-623.
[https://doi.org/10.1111/j.1753-4887.2009.00246.x]

-
Zhou M, Wu L, Liang J, Shen C and Lin J. (2012). Expression analysis and functional characterization of a novel cold-responsive gene CbCOR15a from Capsella bursa-pastoris. Molecular Biology Reports. 39:5169-5179.
[https://doi.org/10.1007/s11033-011-1313-1]