
Amomum muricarpum Elmer 추출물의 Lipopolysachharide에 의한 염증반응 조절 기전 분석
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Identifying new natural products to controlling inflammatory responses involved in screening of Asian native plants. The screening revealed a potential candidate, Amomum muricarpum Elmer, which is a traditional medicinal plant for gastrointestinal diseases in Vietnam; however, its scientific basis remains unknown, its scientific basis remain unknown.
A. muricarpum extract suppressed lipopolysaccharide (LPS)-induced the protein expression of inflammatory mediators such as interleukine (IL)-1β and cyclooxygenase-2 in mouse-derived RAW264.7 macrophages. The mRNA expression levels of IL-6, IL-1β, tumor necrosis factor-α, and inducible nitric oxide synthase in response to LPS were reduced by A. muricarpum extract. Additionally, A. muricarpum extract inhibited phosphorylation of the signal transducer and activator of transcription 3 (STAT3) and nuclear factor kappa B (NF-κB). This result indicates A. muricarpum suppressed the expression of inflammatory cytokines and mediators by inhibiting signal transducer and STAT3 and NF-κB activation.
This is the first scientific evidence to report that A. muricarpum suppresses inflammatory signaling pathways and can potentially manage excessive and chronic inflammatory responses.
Keywords:
Amomum muricarpum Elmer, Inflammation, Lipopolysaccharide, Nuclear Factor Kappa B, Signal Transducer and Activator of Transcription 3서 언
염증반응은 병원체 연관 분자유형 (pathogen-associated molecular pattern, PAMP) 또는 손상 연관 분자유형 (damage-associated molecular pattern, DAMP)이 패턴인식수용체 (Pattern Recognition Receptor, PRR)에 의해 인식되며 진행되는 선천면역 반응이다 (Xiao, 2017; Medzhitov and Janeway, 2000). 염증반응을 유도하는 대표적인 내독소로 알려진 lipopolysaccharide (LPS)는 그람 음성균 세포벽의 주요 성분으로 LPS는 toll-like receptor 4 (TLR4)에 결합한다. 활성화된 TLR4는 전사인자 NF-κB와 signal transducer and activator of transcription 3 (STAT3)의 인산화를 통해 활성화시킨다 (Kim et al., 2017). 그 중 nuclear factor kappa B (NF-κB)는 염증 관련 단백질의 발현을 상향 조절하는데 있어 중요한 전사인자로 알려져 있다 (Schottelius and Baldwin, 1999).
대식세포는 다양한 면역세포들 중에서 초기에 병원체를 인지하고 interleukine (IL)-1β, IL-6, interferon-gamma (INF-γ)와 같은 염증성 사이토카인과 cyclooxygenase-2 (COX-2) 같은 염증 매개 단백질을 분비하여 주변의 휴지기 상태의 대식세포 (M0)를 염증성 대식세포 (M1)으로 활성화시킨다 Lissner, et al., 2015; Yunna et al., 2020). 또한, 자연 살해세포 (NK cell)의 활성을 촉진하여 면역반응을 증폭시키는 기능을 한다 (Bellora et al., 2014). 따라서 대식세포는 다양한 염증 질환 모델에서 중요한 타겟 세포로 연구되고 있다.
적절하게 조절되는 염증반응은 외부 항원을 제거하고 신체를 보호하나, 조절되지 못한 과도한 만성 염증반응으로 진행될 경우 다양한 만성 염증질환의 원인이 된다. 전 세계적으로 5 명 중 3 명이 뇌졸중, 심장 질환, 암, 비만, 만성 호흡기 질환, 당뇨병과 같은 만성 염증질환으로 인해 사망하는 것으로 밝혀졌다 (Barcelos et al., 2019; Tsai et al., 2019). 따라서 대식세포로부터 과발현된 염증성 사이토카인과 매개인자의 발현과 활성을 조절함으로써 만성 염증질환을 치료하기 위한 연구가 활발히 진행되고 있다 (Lissner et al., 2015).
현재 임상에서 사용되고 있는 염증반응 억제제는 스테로이드계 약물과 비스테로이드계 약물이 주로 사용되고 있는데, 이들은 위장관계에 부작용을 유발할 수 있다 (Mpofu et al., 2004). 따라서, 최근에는 스테로이드나 합성화합물과 비교하여 부작용이 적고 안정성이 높은 천연물 추출물에서 항염효능 물질을 찾는 연구가 활발하게 이루어지고 있다.
항염 효능을 갖는 천연물을 찾기 위해 동북아시아 지역 자생식물에 비해 비교적 덜 연구된 동남아시아권 자생식물 추출물 라이브러리를 활용하였다. RAW264.7 대식세포주에 천연추출물과 LPS를 처리하여, IL-1β의 분비를 감소시키는 추출물을 찾는 방법으로 스크리닝을 진행하였고, 그 결과 생강과 (Zingiberaceae)에 속하는 Amomum muricarpum Elmer를 찾을 수 있었다. A. muricarpum은 베트남에서 위장질환 치료에 사용된 전통 약용식물이나, 항염 효능과 그 작용기전에 관한 과학적인 근거와 연구는 미비한 실정이다 (Tsai et al., 1981).
따라서, 본 연구에서는 마우스로부터 유래한 대식세포주 RAW264.7에 그람 음성균의 내독소인 LPS를 처리하여 염증반응을 유도하고, A. muricarpum 추출물의 염증반응 억제 메커니즘을 과학적인 분석을 통해 제시하였다. 이와 같은 결과는 향후 A. muricarpum 추출물이 항염 효능 의약품으로 개발될 수 있는 가능성을 보여준다.
재료 및 방법
1. 실험재료
Amomum muricarpum Elmer는 한국생명공학연구원 해외생물소재센터에서 추출물의 형태로 분양을 받았다 (분양번호; FBM044-085). 분양받은 추출물을 dimethyl sulfoxide로 20 ㎎/㎖ 농도가 되도록 희석하여 실험에 사용하였다. 해외생물소재센터에서 진행된 추출 방법은 다음과 같다.
잎줄기, 열매, 꽃을 따로 분리하여 99.9% 메탄올로 3 일간, 2 시간 간격으로 15 분 동안 초음파 처리를 하였다. 추출물은 여과 후 회전증발기 (N-1000SWD, EYELA, Tokyo, Japan)를 사용하여 농축하였고, 건조기 (Modulspin 40, Biotron Co., Bucheon, Korea)를 통해 건조하였다.
2. 세포배양
RAW264.7 세포주는 American Type Culture Collection(ATCC, Washington DC, USA)에서 구입한 것을 사용하였다. 10% fetal bovine serum (FBS) (Gibco, Carlsbad, CA, USA), 1% penicillin, streptomycin (Gibco, Carlsbad, CA, USA)이 첨가된 DMEM (Gibco, Carlsbad, CA, USA) 배양액을 사용하여 37℃, 5% CO2 incubator (MCO-18AIC, Sanyo, Tokyo, Japan)에서 배양하였다. 또한, RAW264.7 세포주는 2 일 간격으로 계대배양 하였다.
3. Cell viability assay
RAW264.7 세포주를 24 well plate에 24 시간 배양 후, A. muricarpum 추출물을 농도, 시간별로 처리하였다. 3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyltetrazolium Bromide (MTT) stock solution (5 ㎎/㎖)을 각 well 당 100 ㎕를 처리하고 37℃에서 1 시간 배양하였다. 다음 과정으로 formazan을 육안으로 관찰하고 기존 배지를 제거 후 DMSO 200 ㎕로 formazan을 녹여주었다. 96 well plate에 녹인 formazan 200 ㎕를 옮기고 model 680 microplate reader (Bio-Rad, Hercules, CA, USA)를 사용하여 570 ㎚에서 흡광도를 측정하였다. 세포생존율은 다음 식으로 환산하여 나타내었다.
세포생존율 (%) = (시료처리군의 흡광도/대조군의 흡광도) × 100
4. Western blot
RAW264.7 세포주를 배양한 60 ㎜ culture dish의 배지를 제거하고, lysis buffer [150 mM NaCl, 50 mM Tris-Cl (pH 8.0), 1 mM EGTA, 1% Nonidet P-40, 10% glycerol, 10 mM NaF, 0.2 mM phenylmethylsulfonylfluoride, protease inhibitor cocktail, 1 mM Na3VO4]를 이용하여 세포를 lysis 하고 정량하였다. 이후 SDS-PAGE를 수행하고 단백질들을 nitrocellulose membrane (Bio-Rad, Hercules, CA, USA) 으로 transfer하였다. Membrane은 5% 탈지분유 (non-fat dried milk)를 이용하여 30 분 동안 blocking 하였다.
Anti-COX-2, anti-phospho-STAT3, anti-phospho-IκBα, anti-phospho-NF-κB p65 (Ser536), anti-phospho-ERK, anti-phospho-SAPK/JNK (Cell Signaling Technology, Beverly, MA, USA), anti-mouse IL-1β (R&D systems, Minneapolis, MN, USA), anti-β-actin (Santa Cruz Biotechnology, Santa Cruz, CA, USA)의 1차 항체를 4℃에서 overnight incubation 하였다. 이후 anti-rabbit IgG, HRP-linked 또는 anti-mouse IgG, HRP-linked 2차 항체를 이용하여 단백질 발현 여부를 확인하였다.
5. RNA 분리 및 qRT-PCR
60 ㎜ culture dish의 배양액을 제거 후 RiboEx (GeneAll Biotechnology Co., Ltd., Seoul, Korea)를 1 ㎖ 처리하고 상온에서 5 분간 반응시키고 새로운 1.5 ㎖ tube로 옮겼다. Chloroform 200 ㎕을 첨가하고 상온에서 2 분간 반응시켰다. 원심분리기 (5415 R, Eppendorf, Hauppauge, NY, USA)를 이용하여 12,000 × g, 4℃ 조건으로 15 분 동안 원심분리를 진행하고, isopropyl alcohol 1 ㎖을 넣어 섞어주고 상온에서 10 분간 방치하였다. 원심분리를 동일 조건으로 10 분간 진행한 후 상등액을 제거하고 pellet을 75% ethanol 1 ㎖로 세척하고 7,500 × g, 4℃ 조건에서 5 분간 재원심분리 하였다.
최종 분리된 RNA pellet을 dietyl pyrocarbonate (DEPC)를 처리한 dH2O (RNase-free water)에 녹여 nanodrop (Thermo Fisher Scientific Inc., Waltham, MA, USA)을 통해 RNA를 정량 후 –80℃에 보관하였다. 분리된 RNA는 전기영동을 수행하여, 18s와 28s ribosomal RNA를 확인하였다. ReverTra Ace qPCR RT Master Mix with gDNA Remover (Toyobo, Osaka, Japan)을 이용하여 0.5 ㎍의 RNA를 cDNA로 역전사한 뒤, SYBR Green real-time PCR Master Mix (Toyobo, Osaka, Japan)을 이용하여 qPCR을 수행하였다.
PCR 조건은 95℃에서 5 분간 pre-denaturation 한 뒤, 95℃에서 30 초, 58℃에서 30 초, 72℃에서 30 초의 40 cycles로 수행되었다. 상대 정량 분석을 위해 β-actin으로 정규화하였다. qPCR은 Table 1의 primer를 이용하여 AriaMX (Agilent, Santa Clara, CA, USA)에서 수행되었다.
6. Luciferase assay
RAW264.7 대식세포주를 6 well plate에서 하루 동안 배양하고, 다음날 NF-κB reporter gene을 Lipofetamine 3000 (Invitrogen, Carlsbad, CA, USA)으로 transfection하였다. 24시간 후 A. muricarpum 추출물 20 ㎍/㎖을 30 분간 전처리하고, LPS를 100 ng/㎖ 농도로 6 시간 처리하였다.
Reporter lysis buffer (Promega, Madison, WI, USA)를 이용하여 cell을 lysis하고 SpectraMax L microplate reader (Molecular Devices, Sunnyvale, CA, USA)로 발광도를 측정하였다.
7. 통계처리
모든 통계 데이터는 GraphPad Prism software version 5.01 (GraphPad Software Inc., San Diego, CA, USA)을 이용하여 분석하였다. 실험의 모든 결과는 3 회 반복 실험하여 평균 (means) ± 표준편차 (standard deviation)로 나타내었다. 실험 결과에 대한 통계 분석은 student’s t-test를 통해 5% 수준에서 유의성을 평가하였다 (p < 0.05).
결 과
1. A. muricarpum의 세포 독성 확인
A. muricarpum 추출물이 마우스 대식세포주인 RAW264.7에 세포 독성을 유발하는지 확인하기 위해 MTT assay를 수행하여 처리 시간과 농도에 따른 세포생존율을 확인하였다.
RAW264.7 세포주에 A. muricarpum 추출물을 10, 20, 50, 100 ㎍/㎖ 농도로 처리하고 12 시간 뒤 세포생존율을 확인하였다. 그 결과 10, 20, 50, 100 ㎍/㎖ 농도에서 각각 96.9%, 95.4%, 98.4%, 84.8%의 세포생존율을 보였다 (Fig. 1A). 또한, 시간에 따른 세포 독성을 확인한 실험에서 50 ㎍/㎖ 농도로 6, 12, 24 시간 처리하였을 때 93.9%, 98.4%, 103.0%의 생존율을 보였다 (Fig. 1B). 이 결과를 바탕으로 세포 독성이 없는 농도인 20, 50 ㎍/㎖을 이후 실험에서 사용하였다.
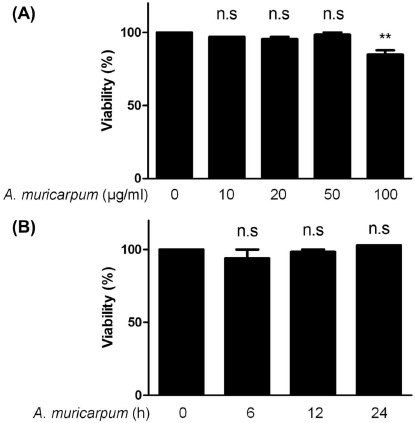
Dose- and time-dependent cytotoxicity of A. muricarpum extract.(A) RAW264.7 cells were treated with A. muricarpum extract for the indicated concentrations. After 12 h of incubation, the cytotoxicity was assessed by MTT assay. (B) RAW264.7 cells were treated with A. muricarpum extract (50 ㎍/㎖) for the indicated times, and the cytotoxicity was measured by MTT assay. The results are represented as the means ± SD of three independent experiments. n.s.; non-significant. **Means significantly different from the control (p < 0.05).
2. A. muricarpum 추출물의 염증 매개 단백질 발현 억제 효과
A. muricarpum 추출물의 항염 효능을 분석하기 위해, LPS로 염증반응을 유도하여 RAW264.7 세포주에서 염증반응 마커로 사용되는 IL-1β, COX-2의 발현 수준을 비교하였다. A. muricarpum 추출물은 LPS를 처리하기 30 분 전에 20, 50 ㎍/㎖로 전처리 하였고 LPS는 100 ng/㎖, 6시간 처리하였다. 이후 Western blot을 수행하여 IL-1β와 COX-2의 단백질 발현량을 확인하였다 (Fig. 2).
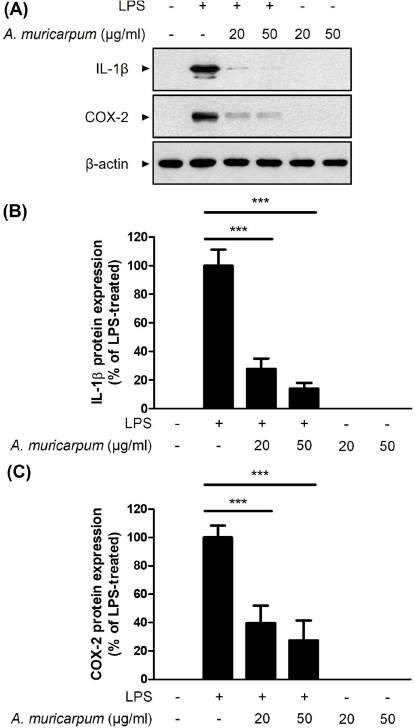
The effect of A. muricarpum extract in the protein expression of LPS-induced inflammatory mediators.(A) RAW264.7 cells were treated with A. muricarpum extract (20 or 50 ㎍/㎖) for 30 min, followed by the LPS (100 ng/㎖) for 6 h. IL-1β, COX-2 and β-actin protein expression levels were analyzed by Western blot analysis. (B and C) IL-1β and COX-2 protein expression levels were compared with the LPS-treated group. The results are represented as the means ± SD of three independent experiments. ***Means significantly different from the LPS-treated group (p < 0.001).
A. muricarpum 추출물 20, 50 ㎍/㎖과 LPS를 처리하였을때 IL-1β 단백질 발현량은 LPS 단독 처리군 (100%)과 비교하여 27.7 ± 10.36%, 14.07 ± 5.67%로 감소하였다 (Fig. 2B). COX-2 단백질 발현량은 LPS 단독 처리군과 비교하여, A. muricarpum 추출물 20, 50 ㎍/㎖과 LPS를 처리하였을 때 39.68 ± 17.41%, 27.51 ± 19.77%로 감소하였다 (Fig. 2C). 따라서, A. muricarpum 추출물이 LPS에 의해 유도되는 염증성 사이토카인과 염증매개 인자의 발현을 억제할 수 있음을 확인하였다.
3. A. muricarpum 추출물의 염증성 사이토카인과 염증매개 인자 mRNA 발현 억제 효과
A. muricarpum 추출물의 항염 효능을 분석하기 위해, 추가적인 염증성 사이토카인과 염증 매개 인자들의 mRNA 발현량 변화를 qPCR을 통해 비교 분석하였다.
RAW264.7 세포주에 LPS를 처리하기 30 분 전 A. muricarpum 추출물을 20, 50 ㎍/㎖로 전처리 하였으며, LPS는 100 ng/㎖, 6 시간 동안 처리하였다. A. muricarpum 추출물 20, 50 ㎍/㎖과 LPS를 처리하였을 때 IL-6의 mRNA 발현량은 LPS 단독 처리군 (100%)과 비교하여 86.59 ± 27.78%, 13.02 ± 7.41%로 감소하였다 (Fig. 3A). IL-1β의 mRNA 발현량은 LPS 단독 처리군과 비교하여 A. muricarpum 추출물을 20 ㎍/㎖ 처리한 경우 21.29 ± 6.94%, 50 ㎍/㎖로 처리한 경우 mRNA가 검출되지 않는 수준까지 감소하였다 (Fig. 3B). TNF-α의 경우 A. muricarpum 추출물 20 ㎍/㎖ 처리군에서는 100.47 ± 9.80%로 LPS 단독 처리군과 비슷한 발현량을 보였으나, 50 ㎍/㎖ 처리군에서는 61.54 ± 12.65%로 mRNA 발현량이 감소하였다 (Fig. 3C). iNOS의 경우에는 A. muricarpum 추출물 20, 50 ㎍/㎖ 처리군 모두에서 mRNA가 검출되지 않는 수준으로 발현이 감소하였다 (Fig. 3D). 이를 바탕으로 A. muricarpum 추출물이 염증성 사이토카인과 염증매개 인자를 mRNA 수준에서 억제할 수 있음을 확인하였다.
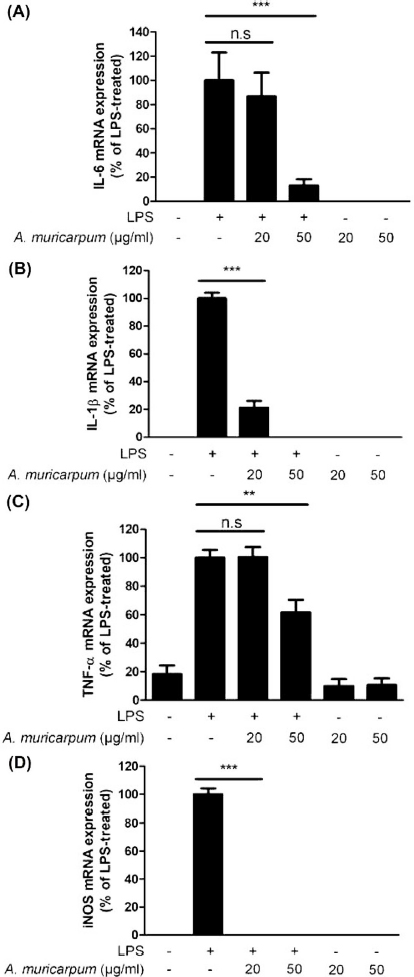
The effects of A. muricarpum extract in the mRNA expression of LPS-induced pro-inflammatory cytokines.RAW264.7 cells were treated with A. muricarpum extract (20 or 50 μg/㎖) for 30 min, followed by the LPS (100 ng/㎖) for 6 h. The mRNA expression levels were determined by qPCR and compared with the LPS-treated group. The results are represented as the means ± SD of three independent experiments. n.s., nonsignificant. Means significantly different from the LPS-treated group (**p < 0.01 and ***p < 0.001).
4. A. Muricarpum 추출물의 전사인자 활성 억제
LPS로부터 유도되는 염증매개 인자와 염증성 사이토카인의 발현은 NF-κB, STAT3 등의 전사인자에 의해 조절될 수 있음이 보고되었다 (Liu et al., 2018). 또한 이러한 전사인자의 활성화는 ERK와 JNK와 같은 MAPKs에 의해 조절될 수 있음이 알려져 있다 (Schulze-Osthoff et al., 2017).
A. muricarpum 추출물에 의한 염증성 사이토카인과 염증매개 인자의 발현 조절 메커니즘을 밝히기 위해 MAPKs와 NF-κB, inhibitor κB (IκB), STAT3의 인산화 수준을 Western blot으로 확인하였다 (Fig. 4).
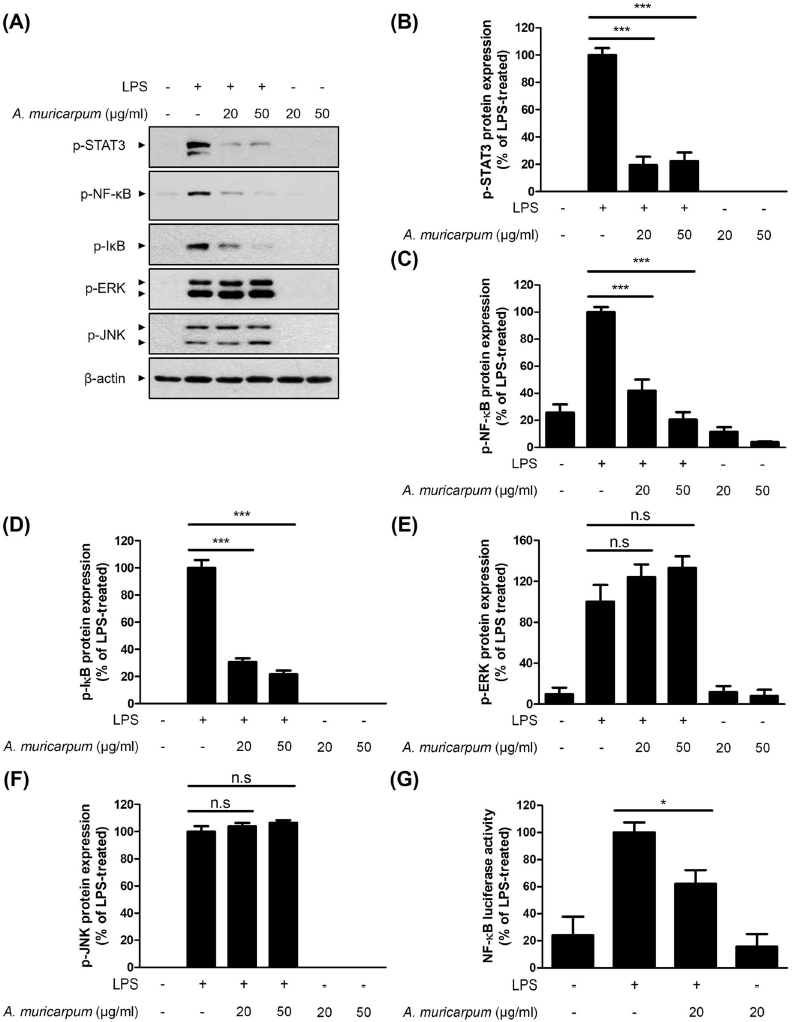
The effect of A. muricarpum extract in LPS-induced MAPKs, NF-κB and STAT3 signaling pathway.(A) RAW264.7 cells were treated with the A. muricarpum extract (20 or 50 ㎍/㎖) for 30 min, followed by the LPS (100 ng/㎖) for 6 h. p-STAT3, p-NF-κB, p-IκB, p-ERK, p-JNK and β-actin protein expression levels were analyzed by Western blot analysis. (B – F) P-STAT3, p-NF-κB, p-IκB, p-ERK and p-JNK protein expression levels were compared with the LPS-treated group. (G) RAW264.7 cells were transfected with NF-κB-luciferase reporter vectors. After 24 h, cells were pretreated with the A. muricarpum extract (20 ㎍/㎖) for 30 min, followed by the LPS (100 ng/㎖) for 6 h. Cell lysates were analyzed for luciferase activity. The results are represented as the means ± SD of three independent experiments. n.s., nonsignificant. Means significantly different from the LPS-treated group (*p < 0.05 and ***p < 0.001).
RAW264.7 세포주에 LPS를 처리하기 전 A. muricarpum 추출물을 20, 50 ㎍/㎖ 농도로 30 분 동안 전처리 하였고, LPS는 100 ng/㎖ 농도로 6 시간 동안 처리하였다. A. muricarpum 추출물 20, 50 ㎍/㎖과 LPS를 처리하였을 때 STAT3의 단백질 발현량은 LPS 단독 처리군과 비교하여 19.34 ± 8.7%, 22.35 ± 8.9%로 감소하였다 (Fig. 4B). NF-κB의 인산화는 A. muricarpum 추출물을 20, 50 ㎍/㎖ 처리하였을 때, 41.90 ± 8.25%, 20.55 ± 5.54%로 감소하였으며 (Fig. 4C), IκB의 인산화도 30.50 ± 8.25%, 20.55 ± 5.54%로 감소하였다 (Fig. 4D). ERK와 JNK의 인산화는 유의미한 변화가 관찰되지 않았으며 (Fig. 4E and Fig. 4F), NF-κB reporter gene assay를 수행한 결과 A. muricarpum 추출물 20 ㎍/㎖을 처리하였을 때 NF-κB의 transcriptional activity가 LPS 단독 처리군과 비교하여 62.05 ± 17.6%로 감소하였다 (Fig. 4G). 결과적으로 A. muricarpum 추출물이 LPS에 의해 유도되는 NF-κB와 STAT3의 활성을 억제하여 염증 매개 인자와 염증성 사이토카인의 발현 감소를 통해 염증반응을 억제하는 것을 확인하였다 (Fig. 5).
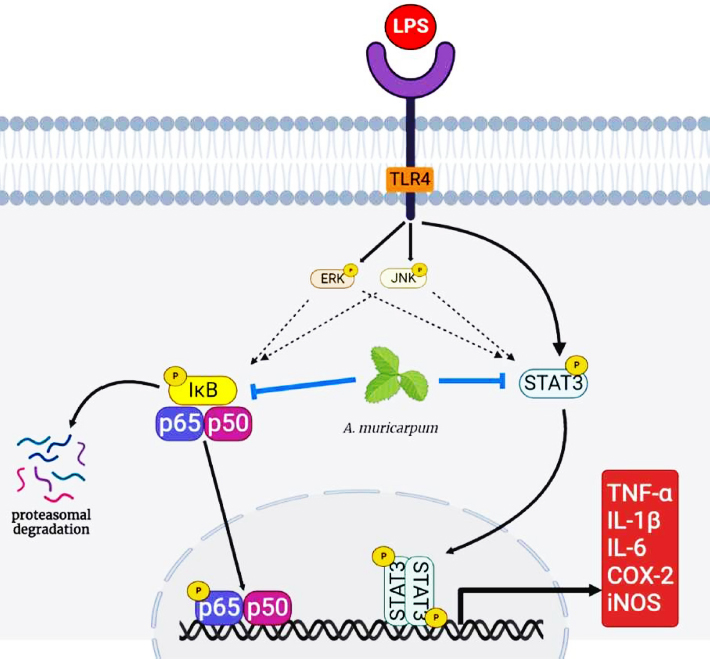
A model of A. muricarpum extract to suppress LPS-induced inflammatory signaling cascade.A. muricarpum extract suppresses the inflammatory signaling pathway by inhibiting the phosphorylation of IκB, NF-κB and STAT3 in the LPS-induced inflammatory response. The figure is created using the Biorender.com program.
고 찰
염증반응은 상처로 인한 세균 또는 바이러스와 같은 병원체의 감염으로부터 신체를 보호하는 방어기전이다 (Lawrence and Fong, 2010). 이때, 대식세포는 염증성 사이토카인과 같은 염증 매개 인자를 분비하여 주변의 면역세포들을 활성화시켜 선천면역과 후천면역에 영향을 준다 (Plowden et al., 2004). 그러나, 이런 염증반응이 조절되지 못하고 장기간 동안 지속될 경우 만성 염증 질환의 원인이 되며 류마티스 관절염, 당뇨병, 심혈관질환 등을 유발할 수 있다 (Choy and Panayi, 2001; Jayashree et al., 2014). 그 중 미생물 감염에 의한 과잉 면역반응은 정상세포까지 공격하게 되는 급성 염증 반응인 사이토카인 폭풍 (cytokine storm)을 유발할 수 있으며, 전신으로 진행될 경우 패혈증으로 인한 사망까지 이어질 수 있다 (Cavaillon, 2018). 따라서, 과도하고 만성적인 염증반응을 조절하는 것이 위와 같은 질병들을 예방하고 치료하는데 중요할 것이라 여겨지고 있다 (Noori et al., 2020).
LPS는 가장 대표적인 PAMP로 대식세포의 TLR4에 인지된다. TLR4는 대식세포 외에 단핵구나 수지상세포에서도 발현되며, LPS를 인지한 TLR4는 NF-κB 전사인자를 활성화시켜 염증반응을 진행시킨다 (An et al., 2002). 추가로 LPS는 JAK/STAT 신호전달경로를 통해 STAT3를 인산화 시켜 최종적으로 IL-1β와 산화질소 생성효소 (inducible Nitric Oxygen Synthase, iNOS)를 발현시켜 염증반응을 유발한다고 알려져 있다 (Kim, et al., 2017).
본 연구에서 A. muricarpum 추출물은 LPS에 의해 유도되는 IL-1β와 COX-2의 단백질 발현량과 IL-6, IL-1β, TNF-α, iNOS의 mRNA 발현량을 농도 의존적으로 감소시키는 것을 확인하였다 (Fig. 2 and Fig. 3). 이러한 결과는 A. muricarpum 추출물이 STAT3와 NF-κB, IκB의 인산화를 농도 의존적으로 저해하기 때문으로 예상된다 (Fig. 4). 인간유래 단핵세포주인 THP-1에서 LPS는 NF-κB와 STAT3의 활성화를 유도하였으며, STAT3의 억제는 염증성 사이토카인의 발현을 억제할 수 있음이 보고되었다 (Liu et al., 2018). 또한, LPS는 STAT3와 TAK1의 활성화를 통해 NF-κB의 인산화를 유도하고, STAT3와 NF-κB가 염증성 사이토카인의 발현을 유도하는 전사인자로 작용한다는 보고도 있다 (Nguyen et al., 2021).
A. muricarpum은 생강과 (Zingiberaceae) 두구속 (Amomum)에 속하는 식물이며 두구속에 포함된 종들은 아시아와 오세아니아에 널리 분포되어 있다 (Cai et al., 2021). 또한 이들의 종자나 열매는 위장질환, 암, 말라리아 등에 전통적인 치료제로 사용되어져 왔다 (Cai et al., 2021).
현재까지 A. muricarpum의 항염효능 메커니즘을 분석한 연구는 부족한 실정이나, 1990년 초부터 두구속 식물들의 에탄올과 메탄올 추출물의 성분을 분석한 연구들이 수행되었다 (Cai et al., 2021). 가장 높은 비중으로 함유된 diarylheptanoid를 비롯하여, flavonoid, terpenoid, coumarin 등을 포함한 160 가지 이상의 성분이 보고되었다 (Cai et al., 2021). 백두구 (Amomum kravanh)에서 추출된 diarylheptanoid 는 대식세포에서 LPS에 의해 유도되는 NO의 생성을 감소시키며, 동시에 NF-κB 전사인자의 신호전달경로를 억제하여 TNF-α, IL-1β의 발현 억제에 효과를 보인다는 연구 결과가 있다 (Yin et al., 2013; Zhang et al., 2020; Vanucci-Bacqué and Bedos-Belval, 2021). 생강의 한 종류인 양강 (Alpinia officinarum)에서 분리된 diarylheptanoid 또한 RAW264.7 세포주에서 LPS에 의해 유도되는 NO의 생성을 저해하여 NF-κB 활성화를 억제함으로써 항염 효능을 나타낼 수 있음이 보고된 바 있다 (Rajaganapathy et al., 2013).
이번 연구에 사용된 A. muricarpum 추출물 또한 iNOS의 mRNA 발현 감소를 통해 염증반응을 감소시켰으며, NF-κB의 활성화 감소를 통해 다른 두구속 식물과 같이 diarylheptanoid 성분이 작용했을 가능성을 생각할 수 있다.
한편, 2006년 A. muricarpum에서 처음으로 발견된 muricarpone B를 물오리나무 (Alnus sibirica)의 껍질에서 분리하여, RAW264.7 세포주에서 항산화 효능과 NO 생성 저해 효능이 보고된 바 있다 (Le et al., 2017). 따라서 A. muricarpum 추출물의 항염 효능을 나타내는 지표성분을 diarylheptanoid 단일 성분으로 단정지을 수는 없을 것으로 사료된다.
본 연구 결과 A. muricarpum 추출물은 현재까지 알려진 두구속 식물들의 항염 효능에서 보고된 바 없는 STAT3 신호전달 기전 억제를 통해, 보다 우수한 항염 효능을 확인할 수 있었다. 따라서 A. muricarpum 추출물의 성분 분석과 STAT3 신호전달 기전 억제 효능을 나타내는 지표성분이 무엇인지에 대한 추가적인 연구가 수행되어야 할 것이다.
본 연구 결과를 통하여 그람 음성균의 내독소 LPS를 통해 유도된 염증반응에 대한 A. muricarpum 추출물의 항염 효능에 대한 메커니즘을 확인한 바, A. muricarpum를 만성 염증질환에 대한 잠재적인 치료제로의 활용 가능성을 제시하고자 한다.
Acknowledgments
본 연구는 한국연구재단(NRF-2021R1A2C1008170)과 KRIBB Initiative Program의 지원에 의하여 이루어진 결과로 이에 감사드립니다.
References
-
An H, Yu Y, Zhang M, Xu H, Qi R, Yan X, Liu S, Wang W, Guo Z, Guo J, Qin Z and Cao X. (2002). Involvement of ERK, p38 and NF-κB signal transduction in regulation of TLR2, TLR4 and TLR9 gene expression induced by lipopolysaccharide in mouse dendritic cells. Immunology. 106:38-45.
[https://doi.org/10.1046/j.1365-2567.2002.01401.x]

-
Barcelos IP, Troxell RM and Graves JS. (2019). Mitochondrial dysfunction and multiple sclerosis. Biology. 8:37. https://www.mdpi.com/2079-7737/8/2/37, (cited by 2023 Jan 24).
[https://doi.org/10.3390/biology8020037]

-
Bellora F, Castriconi R, Dondero A, Pessino A, Nencioni A, Liggieri G, Moretta L, Mantovani A, Moretta A and Bottino C. (2014). TLR activation of tumor-associated macrophages from ovarian cancer patients triggers cytolytic activity of NK cells. European Journal of Immunology. 44:1814-1822.
[https://doi.org/10.1002/eji.201344130]

-
Cai R, Yue X, Wang Y, Yang Y, Sun D, Li H and Chen L. (2021). Chemistry and bioactivity of plants from the genus Amomum. Journal of Ethnopharmacology. 281:114563. https://www.sciencedirect.com/science/article/pii/S0378874121007923, (cited by 2022 Nov 28).
[https://doi.org/10.1016/j.jep.2021.114563]

-
Cavaillon JM. (2018). Exotoxins and endotoxins: Inducers of inflammatory cytokines. Toxicon. 149:45-53.
[https://doi.org/10.1016/j.toxicon.2017.10.016]

-
Choy EHS and Panayi GS. (2001). Cytokine pathways and joint inflammation in rheumatoid arthritis. New England Journal of Medicine. 344:907-916.
[https://doi.org/10.1056/NEJM200103223441207]

-
Jayashree B, Bibin YS, Prabhu D, Shanthirani CS, Gokulakrishnan K, Lakshmi BS, Mohan V and Balasubramanyam M. (2014). Increased circulatory levels of lipopolysaccharide(LPS) and zonulin signify novel biomarkers of proinflammation in patients with type 2 diabetes. Molecular and Cellular Biochemistry. 388:203-210.
[https://doi.org/10.1007/s11010-013-1911-4]

-
Kim SH, Park SY, Park YL, Myung DS, Rew JS and Joo YE. (2017). Chlorogenic acid suppresses lipopolysaccharide-induced nitric oxide and interleukin-1β expression by inhibiting JAK2/STAT3 activation in RAW264.7 cells. Molecular Medicine Reports. 16:9224-9232.
[https://doi.org/10.3892/mmr.2017.7686]

-
Lawrence T and Fong C. (2010). The resolution of inflammation: Anti-inflammatory roles for NF-κB. The International Journal of Biochemistry and Cell Biology. 42:519-523.
[https://doi.org/10.1016/j.biocel.2009.12.016]

-
Le TT, Yin J and Lee MW. (2017). Anti-inflammatory and anti-oxidative activities of phenolic compounds from Alnus sibirica stems fermented by Lactobacillus plantarum subsp. argentoratensis. Molecules. 22:1566. https://www.mdpi.com/1420-3049/22/9/1566, (cited by 2023 Jan 24).
[https://doi.org/10.3390/molecules22091566]

-
Lissner D, Schumann M, Batra A, Kredel LI, Kühl AA, Erben U, May C, Schulzke JD and Siegmund B. (2015). Monocyte and M1 macrophage-induced barrier defect contributes to chronic intestinal inflammation in IBD. Inflammatory Bowel Diseases. 21:1297-1305.
[https://doi.org/10.1097/MIB.0000000000000384]

-
Liu X, Yin S, Chen Y, Wu Y, Zheng W, Dong H, Bai Y, Qin Y, Li J, Feng S and Zhao P. (2018). LPS-induced proinflammatory cytokine expression in human airway epithelial cells and macrophages via NF-κB, STAT3 or AP-1 activation. Molecular Medicine Reports. 17:5484-5491.
[https://doi.org/10.3892/mmr.2018.8542]

-
Medzhitov R and Janeway JC. (2000). Innate immunity. New England Journal of Medicine. 343:338-344.
[https://doi.org/10.1056/NEJM200008033430506]

-
Mpofu S, Mpofu CMA, Hutchinson D, Maier AE, Dodd SR and Moots RJ. (2004). Steroids, non-steroidal anti-inflammatory drugs, and sigmoid diverticular abscess perforation in rheumatic conditions. Annals of the Rheumatic Diseases. 63:588-590.
[https://doi.org/10.1136/ard.2003.010355]

-
Nguyen TLL, Huynh DTN, Jin YJ, Jeon HS and Heo KS. (2021). Protective effects of ginsenoside-Rg2 and -Rh1 on liver function through inhibiting TAK1 and STAT3-mediated inflammatory activity and Nrf2/ARE-mediated antioxidant signaling pathway. Archives of Parmacal Research. 44:241-252.
[https://doi.org/10.1007/s12272-020-01304-4]

-
Noori MS, Courreges MC, Bergmeier SC, McCall KD and Goetz DJ. (2020). Modulation of LPS-induced inflammatory cytokine production by a novel glycogen synthase kinase-3 inhibitor. European Journal of Pharmacology. 883:173340. https://www.sciencedirect.com/science/article/pii/S0014299920304325, (cited by 2022 Nov 28).
[https://doi.org/10.1016/j.ejphar.2020.173340]

-
Plowden J, Renshaw-Hoelscher M, Engleman C, Katz J and Sambhara S. (2004). Innate immunity in aging: Impact on macrophage function. Aging Cell. 3:161-167.
[https://doi.org/10.1111/j.1474-9728.2004.00102.x]

-
Rajaganapathy BR, Thirugnanam K, Shanmuganathan MV, Singaravelu A and Subadhra LB. (2013). Molecular basis of the anti-inflammatory potential of a diarylheptanoid in murine macrophage RAW264.7 cells. Advances in Biological Chemistry. 3:514-548.
[https://doi.org/10.4236/abc.2013.36061]

-
Schottelius AJ and Baldwin JAS. (1999). A role for transcription factor NF-κB in intestinal inflammation. International Journal of Colorectal Disease. 14:18-28.
[https://doi.org/10.1007/s003840050178]

-
Schulze-Osthoff K, Ferrari D, Riehemann K and Wesselborg S. (1997). Regulation of NF-κB activation by MAP kinase cascades. Immunobiology. 198:35-49.
[https://doi.org/10.1016/S0171-2985(97)80025-3]

-
Tsai DH, Riediker M, Berchet A, Paccaud F, Waeber G, Vollenweider P and Bochud M. (2019). Effects of short- and long-term exposures to particulate matter on inflammatory marker levels in the general population. Environmental Science and Pollution Research International. 26:19697-19704.
[https://doi.org/10.1007/s11356-019-05194-y]

- Tsai HT, Chen PS and Zhao SW. (1981). Amomum. In Wu, TL. (ed.). Flora reipublicae popularis sinicae. Science Press. Beijing, China. p.110-135.
-
Vanucci-Bacqué C and Bedos-Belval F. (2021). Anti-inflammatory activity of naturally occuring diarylheptanoids-A review. Bioorganic and Medicinal Chemistry. 31:115971. https://www.sciencedirect.com/science/article/pii/S0968089620308014, (cited by 2022 Nov 28).
[https://doi.org/10.1016/j.bmc.2020.115971]

-
Xiao TS. (2017). Innate immunity and inflammation. Cellular and Molecular Immunology. 14:1-3.
[https://doi.org/10.1038/cmi.2016.45]

-
Yin H, Luo JG and Kong LY. (2013). Diarylheptanoids from the fruits of Amomum kravanh and their inhibitory activities of nitric oxide production. Phytochemistry Letters. 6:403-406.
[https://doi.org/10.1016/j.phytol.2013.05.004]

-
Yunna C, Mengru H, Lei W and Weidong C. (2020). Macrophage M1/M2 polarization. European Journal of Pharmacology. 877:173090. https://www.sciencedirect.com/science/article/pii/S0014299920301825, (cited by 2022 Nov 28).
[https://doi.org/10.1016/j.ejphar.2020.173090]

-
Zhang JS, Cao XX, Yu JH, Yu ZP and Zhang H. (2020). Diarylheptanoids with NO production inhibitory activity from Amomum kravanh. Bioorganic and Medicinal Chemistry Letters. 30:127026. https://www.sciencedirect.com/science/article/pii/S0960894X20300962, (cited by 2023 Jan 24).
[https://doi.org/10.1016/j.bmcl.2020.127026]

