눈연꽃 추출물의 Lyn과 Syk 인산화 억제를 통한 알레르기성 염증 억제 효과
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Snow lotus [Saussurea involucrata (Kar. & Kir.) Sch. Bip.] is used in Chinese herbal medicine because of its antioxidant and anti-inflammatory effects. The mechanism of its anti-inflammatory effect on allergic response is unknown.
We evaluated the effect of the aqueous extract of S. involucrata flowers on the allergic inflammatory response in dinitrophenyl-immunoglobulin E (DNP-IgE)-activated RBL-2H3 cells. Cell viability and β-hexosaminidase release from the activated RBL-2H3 cells were evaluated. The levels of proinflammatory molecules including tumor necrosis factor-alpha (TNF-α), interleukin (IL)-4, IL-10, IL-1β, and prostaglandin E2 in RBL-2H3 cells treated with 5% and 10% S. involucrata extract. Treatment with S. involucrata extract significantly suppressed the phosphorylation of protein kinase B (AKT), p38, c-Jun N-terminal kinase (JNK), extracellular signal-regulated kinase (ERK)1/2, and mitogen-activiated protein kinase (MEK) in a dose-dependent manner. S. involucrata extract also inhibited the Fc epsilon receptor 1 signaling pathway involving phosphorylation of Lyn, Syk, and phosphoinositide 3-kinase (PI3K), which is associated with the PI3K-AKT-ERK pathway and cytokine expression. A major mechanism of action of S. involucrata extract was to reduce the extent of the DNP-IgE-induced cytoskeletal change from globular to filamentous actin in RBL-2H3 cells.
S. involucrata extract mediates its antiallergic effect by suppressing inflammation. The findings will be valuable in the development of S. involucrata extract as a phytomedicine with minimal side effects for allergic diseases.
Keywords:
Saussurea involucrata (Kar. & Kir.) Sch. Bip., Anti-allegic Inflammation, Cytokine, β-Hexosaminidase, f-Actin서 언
알러지성 염증은 환경오염의 오염원, 자외선, 비만과 같은 성인병으로 인해 발생하며, 이 같은 원인으로 면역체계의 이상이 발생하게 된다 (Kim et al., 2018; Park et al., 2019). 이때 발생되는 히스타민은 외부자극에 의해 신체가 빠른 방어를 하기위해 분비하는 물질 중 하나로 상처가 난 부위를 붉게 변화시키거나, 피부를 부어오르게 하고, 통증을 유발시키는 염증반응물질이다 (Tabakawa et al., 2018). 히스타민은 호염구, 비만세포 등에 존재하며 면역물질과 면역세포의 반응을 통해 감염원을 제거하거나 불활성화 시키는 작용을 한다 (Larsen et al., 2018; Xu and An, 2017).
아토피 질환은 환자에게 큰 고통을 동반하기 때문에 치료법으로 항히스타민제가 개발되었고, 항히스타민 제품에 대한 부작용 연구가 진행되었다 (Tannert et al., 2017). 히스타민 수용체는 인체에 독특하게 분포되어 있으며, 다양한 조직 기능이 다양한 기능을 갖는다. 알레르기성 비염, 천식, 아토피성 피부염, 결막염 및 두드러기에 동반되는 기타 피부질환 등 다양한 질환의 선택적 조절을 유도하여 상이한 신호전달 경로에 직접 활성화 기능뿐 아니라 T 세포를 조절하여 새로운 치료제 개발을 하고자 하였다 (Bui et al., 2017). 항히스타민제의 복용은 장내 약물수송의 생체이용률 영향을 받기 때문에 약물의 흡수를 방해할 가능성이 있다.
항히스타민 제는 말초 및 중추 신경 부작용을 일으킬 가능성이 있기 때문에 식품 알레르기 및 아나필락시스 가이드 라인은 초기 약물 선택에 항히스타민제 사용을 권장하지 않는다 (Hirzallah and Choi, 2016; Štromberga et al., 2017). 아토피환자들에게 항히스타민제 복용 외의 새로운 약물에 대한 개발이 요구되고 있다.
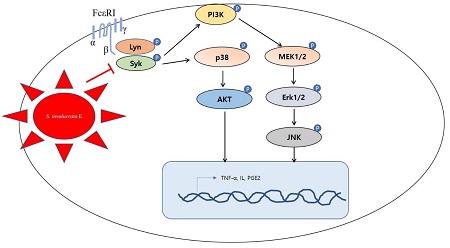
The high-affinity IgE receptor (FcεRI 또는 Fc epsilon RI)는 IgE 수용체로 외부의 자극 면역에 관여하는 항체와 고도의 친화력을 갖는 수용체이다. FcεRI 는 비만세포, 호염구 및 활성화된 호산구에서 발견되며, 이 수용체는 알레르기 반응을 제어하는 데 중요한 역할을 한다 (Kim et al., 2017; Draberova et al., 2019). FcεRI는 항원이 세포에 접촉하면 첫 번째 반응부위로 염증을 촉진하는 중요한 면역 조절 매개체 (싸이토카인, 인터류킨, 백류코트리엔 및 프로스타글란딘)의 생산을 제어한다. 특히, 히스타민을 조절하여 염증 증상을 유발 시키게 된다 (Seresirikachorn et al., 2019). FcεRI 발현은 염증성 싸이토카인을 생성시키고 호염구의 탈과립 및 알레르기 질환에 큰 상관관계를 갖는다. 비만세포 (RBL-2H3)에서 FcεRI은 Tyrosine-protein kinase의 종류인 Lyn 및 Syk을 조절하여 phosphatidylinositol 3-kinase (PI3K) 및 5' AMP-activated protein kinase (AMPK)에 영향을 준다. Lyn 및Syk의 인산화는 세포내 칼슘을 방출시키고, T helper 세포를 활성화시켜 호염구의 탈과립-염증을 유발한다 (Lin et al., 2016).
눈연꽃의 학명은 Saussurea involucrata (Kar. & Kir.) Sch. Bip. (S. involucrata)으로 국화과 에키네시아속의 다년생꽃으로 설연화로 불린다. 중국 해발 2,400 m - 4,100 m의 가파른 절벽에 자라며 예로부터 감기, 혈액순환 촉진, 자궁수축, 불규칙한 월경, 류마티스염, 항염증 및 진통의 기능을 가지고 있어 이용되었다 (Zhang et al., 2017). 눈연꽃에 포함된 단일물질은 플라보노이드, 페닐프로판올, 다당류, 알칼로이드 및 락톤이 포함되어 있으며, 이러한 물질들은 항산화, 항염증, 혈관 손상과 같은 약리적 효과가 검증되었다 (Liou et al., 2017; Wang et al., 2020). 눈연꽃 추출물은 세포를 보호하고, 염증을 완화시키는 물질로 알려져 있다. 이러한 효과를 이용해 오랜 기간동안 중국에서 전통의약으로 이용되었고 (Zhang et al., 2017), 고산지대 높은 절벽에서 자라고 있음에도 많이 채집되고 있다. 재배법 개발을 통해 좀 더 용이하게 이용될 수 있으면 제약으로의 가능성이 더 원활이 진행될 것으로 보인다.
눈연꽃의 항염증작용은 싸이토카인류의 분석에만 그치며, 그 구체적인 메커니즘은 알려진 바가 없기 때문에 본 연구에서는 눈연꽃의 항염증 작용을 세포신호와 기전 및 염증성 싸이토카인 억제 효과를 확인하는 연구를 진행하였다.
재료 및 방법
1. 실험재료
실험에 이용한 눈연꽃 [Saussurea involucrata (Kar. & Kir.) Sch. Bip. (S. involucrata)]은 단정바이오에서 판매되는 건조된 꽃부분을 열수추출한 눈연꽃 추출물 (액상타입)을 구입하여 연구재료로 사용하였다. 추출에 이용된 눈연꽃 원재료는 중국에서 수출 시 통관 허가된 제품으로 통관 시 학명을 확인하였다.
2. 세포배양
RBL-2H3 세포는 한국세포주은행 (Seoul, Korea)으로부터 분양 받아 실험에 사용하였다. 배양액은 RPMI-1640 (Capricorn, Ebsdorfergrund, Germany) 배지에 10% fetal bovine serum (Hyclone Labs, Thermo Scientific Inc., Rockford, IL, USA)와 1% penicillin streptomycin (Capricorn, Ebsdorfergrund, Germany)이 포함되도록 제조하였다.
48-well plate (SPL life science Inc., Pocheon, Korea)에 2 × 105 cells/well으로 세포를 처리하고 18 시간 배양한 후 Dulbecco’s phosphate-buffered saline (DPBS, Welgene Inc., Daegu, Korea)로 2회 세척한 뒤 anti-dinitrophenyl (DNP)-immunoglobulin E (IgE, Sigma-Aldrich Co., St. Louis, MO, USA)를 1 ㎍/㎖의 농도로 처리 후 24 시간 배양하였다. DPBS로 2 회 세척하여 잔여 IgE를 제거 후 추출물을 312, 625 및 1,250 ㎍/㎖ 처리한 후 1 시간 뒤에 dinitrophenyl-bovine serum albumin conjugate (DNP-BSA, Sigma-Aldrich Co., ST. Louis, MO, USA)를 6 시간 동안 처리하였다. 반응을 정지시키기 위해 얼음위에 10 분간 방치 후 배양액을 회수하였고 4℃ 2,000 rpm으로 10 분간 원심분리한 후 상층액을 회수하였다. 양성대조군으로 dexametason (Sigma-Aldrich Co., St. Louis, MO, USA), PP2 (Src family kinase inhibitor, Selleckchem, Houston, TX, USA)을 이용하였다.
3. β-Hexosamididase 측정
면역염증 시험에서 회수한 배양액 25 ㎕를 p-nitrophenyl N-acetyl-β-D-glucosamide (p-NAG, 10 mM, Sigma Aldrich Co., St. Louis, MO, USA)를 포함하는 0.1M sodium citrate buffer (pH 4.5)를 50 ㎕ 첨가하여 96-well plate (SPL life science Inc., Pocheon, Korea)에 처리하고 37℃에서 1시간 반응시켰다. 반응 종료 후 β-hexosaminidase activity를 micorplate reader (Molecular Devices LLC, Sunnyvale, CA, USA)로 405 ㎚에서 흡광도를 측정하였다.
4. Cytokine 및 PGE2 측정
면역염증 시험에서 회수한 배양액 50 ㎕를 이용하여 tumor necrosis factor-α (TNF-α, R&D Systems Inc., Minneapolis, MN, USA), interleukin (IL)-6 (MyBioSource, San Diego, CA, USA), IL-1β (MyBioSource, San Diego, CA, USA), prostaglandin E2 (PGE2, R&D Systems Inc., Minneapolis, MN, USA) ELISA kit를 이용하여 microplate reader로 450 ㎚에서 흡광도를 측정하였다.
5. 세포독성 측정
RBL-2H3 세포주를 1 × 104 세포수로 처리 후 12 시간 배양한 뒤 눈연꽃 추출물을 312, 625 및 1250 ㎍/㎖로 처리 후 24 시간 추가배양하였다. 각 well에 20 ㎕의 MTS (Promega Inc., Madison, WI, USA) 처리 후 호일로 감싸고 20 분간 배양한 뒤 micorplate reader로 450 ㎚에서 흡광도를 측정하였다.
6. 총 단백질 발현분석
RBL-2H3 세포주를 60㎜ 세포배양 접시 (SPL life science Inc., Pocheon, Korea)에 4.5 × 105 세포수로 12 시간 배양한 뒤 눈연꽃 추출물 312, 625 및 1250 ㎍/㎖를 처리한 후 24 시간동안 추가배양한 후 세포를 수집하였다. Phosphatase inhibitor cocktail (ATTO, Tokyo, Japan)과 protease inhibitor cocktail (ATTO, Tokyo, Japan)가 포함된 radioimmunoprecipitation (RIPA) lysis buffer (ATTO, Tokyo, Japan)를 이용하여 얼음에 1 시간 동안 분해한 뒤 13,000 rpm에서 15 분간 원심분리기 (Hanil, Daejeon, Korea)로 원심분리를 실시하였다. 상층액을 Pierce™ BCA Protein Assay Reagent (Thermo Fisher Inc., San Jose, CA, USA)를 이용하여 정량한 뒤 20 ㎍의 단백질을 SDS-PAGE gel method를 이용하여 전기영동하고 membrane에 transfer 하였다.
1 × PBS-T (LPS solution, Daejeon, Korea)로 5% skim milk (KisanBio Co., Seoul, Korea)를 제조하여 1 시간 동안 blocking한 뒤 1 차 항체를 각각 1 : 1,000의 농도로 16 시간 4℃의 냉장실에 반응시켰다. 3 회 PBS-T로 세척한 뒤 2차 항체를 각각 1 : 5,000의 농도로 실온에서 처리 후 다시 3 회 PBS-T로 세척 후 Amersham ECL western blotting detection reagent (GE Healthcare, Chicago, IL, USA)를 이용하여 발색 후 Amersham imager 680 (GE Healthcare, Chicago, IL, USA)으로 측정하였다. 발색은 ImageQuantTL software (GE Healthcare, Piscataway, NJ)를 이용하여 분석하였다.
항체는 anti-protein kinase B (AKT), anti-p-AKT, anti-p-p38, anti-p-c-Jun N-terminal kinases (JNK), anti-p-Mitogen-activated protein kinase 3(Erk)1/2, anti-p-mitogen-activated protein kinase (MEK) (Santa Cruz Biotechnology, Inc., Dallas, TX, USA), anti-p-tyrosine-protein kinase Lyn (Lyn), anti- p- Src family tyrosine kinase (Fyn), anti-p- spleen tyrosine kinase (Syk, Cell Signaling, Beverly, MA, USA)을 이용하였다.
7. F-actin 분석
RBL-2H3 세포주를 60 ㎜ 세포배양 접시 (SPL life science Inc., Pocheon, Korea)에 4.5 × 105 세포수로 12 시간 배양한 뒤 눈연꽃 추출물 312, 625 및 1250 ㎍/㎖로 24 시간동안 처리한 후 세포를 수집하였다. 1 × 105개의 세포를 회수하여 pH 7.4 DPBS로 세척 후 100 ㎕ fluorescence-activated cell sorting (FACS) buffer, DPBS + 0.5% BSA (Sigma-Aldrich Co., ST. Louis, MO, USA) + 0.1% sodium azide (Sigma-Aldrich, ST. Louis, MO, USA)에 현탁시키고, 0.1% Triton을 10 분간 얼음위에서 처리하여 permeabilization 과정을 진행하였다.
세포를 200 ㎕의 DPBS로 3 회 세척 후 100 ㎕의 FACS buffer에 5 ㎕의 f-actin antibody (Abcam, Cambridge, MA, USA)를 세포에 첨가하여 1 시간 동안 냉장 처리하였다. 200 ㎕의 DPBS로 3 회 세척 후 allophycocyanin (APC) 결합된 2 차 항체 (Thermo Fisher Inc., Waltham, MA, USA)를 1 : 1,000으로 처리하여 반응시켰다. 염색한 세포를 200 ㎕의 DPBS로 3 회 세척 후 300 ㎕의 FACS 버퍼를 첨가하여 flow cytometry (FACS, Attune NxT, Invitrogen, Camarillo, CA, USA)를 사용하여 분석하였다.
8. 통계분석
모든 생리활성 실험은 3 회 반복 실험을 통해 수치화 하였으며, 통계분석은 One-way ANOVA로 신뢰구간 p < 0.05으로 Bonferroni 사후검정을 실시하였다. 통계프로그램은 Graph Pad Prism 5 software (Graph Pad Software Inc., La Jolla, CA, USA)를 이용하였다.
결과 및 고찰
1. 눈연꽃 추출물의 세포독성
본 연구에서는 눈연꽃 [Saussurea involucrata (Kar. & Kir.) Sch. Bip. (S. involucrata)] 추출물의 항염증 작용을 관찰하기 위해 RBL-2H3에서 추출물이 갖는 세포독성을 확인하였다 (Fig. 1A). 눈연꽃 추출물이 실험농도 312, 625 및 1250 ㎍/㎖에서 세포독성이 확인되지 않았다.
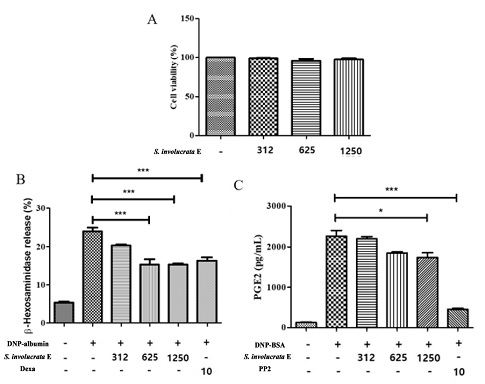
Effect of Saussurea involucrata (Kar. & Kir.) Sch. Bip. extract on cell viability, β-hexosaminidase and histamine marker (PGE2) release degranulation in IgE-stimulated rat basophilic leukemia (RBL-2H3) cells.(A); Cell viability assay. RBL-2H3 cells (1 × 104 cells/well)were seeded in a 96-well plate overnight at 37℃ and incubated with S. involucrata E (312, 625 and 1,250 ㎍/㎖) for 24 hr. The MTS in vitro cytotoxicity assay was used for assessing cell viability. All values are the mean ± S.D. of three independent experiments. Values of ***p < 0.001 were considered significantly different to the anti-DNP IgE plus DNP-BSA, One-way ANOVA. (B); β-hexosaminidase release. RBL-2H3 cells (2 × 105 cells/well)were seeded in a 48-well plate overnight at 37℃ and incubated with anti-dinitrophenyl (DNP)-IgE (1 ㎍/㎖) for 18 h. The IgE-sensitized cells were preincubated with S. involucrata E (1, 5, and 10%, v/v) or dexamethasone (10 μM) for 1 h, and subsequently stimulated with the dinitrophenyl-bovine serum albumin conjugate (DNP-BSA) (10 μg/ml) for 4 h. Value (%) Was calculated based on the O.D measurement of the blank of the untreated cell group. (C); prostaglandin E2 (PGE2) release. IgE-sensitized RBL-2H3 cells were preincubated with S. involucrata E, dexamethasone (10 μM), or PP2 (10 μM) for 1 h before antigen treatment for 6 h. All values are the means ± S.D. of three independent experiments. Values of *p < 0.05, **p < 0.01, and ***p < 0.001 were considered significantly different to the anti-DNP IgE plus DNP-BSA, One-way ANOVA.
독성시험이 이용된 MTS 기법은 미토콘드리아에서 배출되는 mitochondrial dehydrogenase와 반응하는 MTS 계열의 시약을 이용하여 세포의 증식률 또는 세포독성을 측정한다 (Wang et al., 2010). 이러한 시약은 MTT에서 용해도가 낮은 문제를 개선하여 쉽게 세포를 이용한 측정이 가능하도록 하였다. 세포에 처리되는 눈연꽃 추출물은 세포의 모양을 변화시키지 않았고, 증식을 유도하지도 않았다. 즉 염증치료 시 독성이 없기 때문에 안전한 약물로 개발 가능하다고 판단하였다.
2. 눈연꽃 추출물의 β-hexosaminidase 및 염증성 싸이토카인 발생억제
염증은 외부 자극에 의해 반응하여 상처를 유발하는데 복잡한 기전으로 발적, 발열, 종창, 동통 등의 증상이 나타난다 (Bundgaard et al., 2018). 염증상태에서의 과도한 싸이토카인이 생성되고, 혈관투과성, 부종 등의 염증반응을 촉진시킬 뿐만 아니라, 염증 매개체의 생합성을 촉진하여 급성과 만성염증을 유발하여 조직의 손상 및 유전자 변이 등을 일으킬 수 있다 (Kawanishi et al., 2017; Bundgaard et al., 2018).
눈연꽃 추출물을 RBL-2H3의 IgE 자극과 함께 반응시켰을 때 β-hexosaminidase의 분비가 625 ㎍/㎖ 눈연꽃 추출물이 함께 처리된 군에서 8.6 ± 2.5% 감소하였고 (p < 0.001), 덱사메타손 10 μM 처리군과 유사한 억제효과를 보였다 (Fig. 1B). 염증의 초기 단계에서 국소적인 혈관 확장 및 호중구, 대식세포, 비만세포의 활성화를 촉진하는 염증의 활성을 일으키는 매개체인 PGE2를 확인한 결과 PGE2에서는 1250 ㎍/㎖의 눈연꽃 추출물부터 억제효과를 확인하였다 (p < 0.05, Fig. 1C). 싸이토카인 3 종류 (TNF-α, IL-6, 및 IL-1β)중 IL-6를 제외한 TNF-α 및 IL-1β에서 625 ㎍/㎖의 눈연꽃 추출물이 함께 처리된 군에서 감소되는 효과를 확인하였고 (p < 0.05, Fig. 2B and 2C), IL-6는 통계적으로 유의한 차이를 보이지 않았다. 면역 자극인 DNP-BSA에 의해 유도된 항알러지 타겟인자인 β-hexosaminidase 및 PGE2를 감소시켰고, 염증성 싸이토카인인 TNF-α 및 IL-1β를 억제시켜 염증을 완화시킨 것으로 확인된다.
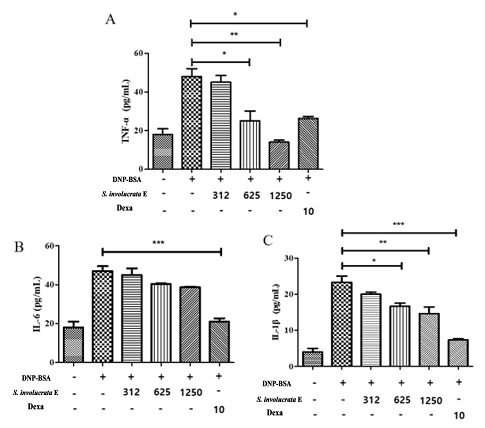
Effect of Saussurea involucrata (Kar. & Kir.) Sch. Bip. extract on degranulation in IgE-stimulated inflammatory cytokine production in IgE-stimulated RBL-2H3 cells.(A); TNF-α release. RBL-2H3 cells (2 × 105 cells/well)were seeded in a 48-well plate overnight at 37℃ and incubated with anti-dinitrophenyl (DNP)-IgE (1 ㎍/㎖) for 18 h. The IgE-sensitized cells were preincubated with S. involucrata E (1, 5, and 10%, v/v) or dexamethasone (10 μM) for 1 h, and subsequently stimulated with the dinitrophenyl-bovine serum albumin conjugate (DNP-BSA) (10 ㎍/㎖) for 4 h. (B); IL-6 release, (C); IL-1β release. Values of *p < 0.05, **p < 0.01, and ***p < 0.001 were considered significantly different to the anti-DNP IgE plus DNP-BSA with One-way ANOVA and Bonferroni post-test.
면역자극을 통해 활성화되는 염증성 싸이토카인 중 TNF-α는 대식세포를 자극하기도 하며 염증반응을 촉진하는 등 내재면역반응 (innate immune response)에 폭넓게 관여하는 신호분자이다. 또한, IL-1β는 열을 발생시키는 특징으로 내인성적인 역할로 보고된 바 있다 (Hagman et al., 2019). IL-1β는 만성 염증성 질환과 자가면역 증세에 관련이 깊어 이를 차단하는 다양한 방법들이 임상적으로 관심의 대상이 되었다. TNF-α 및 IL-1β는 마크로파지와 같은 세포의 Fc 수용체를 자극하는 면역글로불린 E (IgE)를 자극하여 FcεRI 신호전달경로를 조절하며, 아나필락시스 반응 (과민증 항원항체반응)을 일으켜 알러지성 염증을 유발한다 (Kong et al., 2020).
본 연구진은 눈연꽃 추출물을 이용하여 FcεRI 신호전달경로 조절을 보고한 논문이 없었기 때문에 위 실험을 통해 항염을 구체적으로 분석하고, β-hexosaminidase, PGE2, TNF-α 및 IL-1β의 조절이 FcεRI의 신호경로와 관련이 있는지 단백질 수준의 확인이 필요하였다.
3. 눈연꽃 추출물의 단백질 수준 변화
염증성 매개물질 (히스타민, 비만세포 키마제, 트립타제, 세린에스테라제)은 matrix metalloprotease (MMP)를 활성화시켜 조직 세포간질을 파괴시킨다 (Patruno et al., 2018). 일부 세포들에서 세포부착분자 (adherent molecule)의 가교성을 억제시키고, 염증성 백혈구 및 림프구의 유입을 조장하게 된다. 이러한 과정에서 다양한 세포신호가 조절하는데 FcεRI 신호전달 경로가 중요한 역할을 한다 (Kong et al., 2020). IgE 결합부위인 FcεRIα 외부막 결합부위를 인지하여 Lyn과 Syk 신호뿐 아니라 PLCγ와 같은 신호를 자극하여 면역활성을 유도하는 신호를 조절한다.
눈연꽃 추출물을 이용하여 세포내 단백질 수준의 FcεRI 신호전달경로를 확인할 결과 IgE 자극에 의해 증가된 Lyn과 Syk 인산화를 눈연꽃 추출물 5% 처리군부터 10% 처리군까지 감소시켰다. 눈연꽃 추출물 처리 시 PI3K의 레벨도 농도의존적으로 감소하는 것을 확인하였다 (Fig. 3A). PI3K와 함께 MAPK 신호전달경로의 변화를 확인하였고, 눈연꽃 추출물 처리시 농도 의존적으로 MAPK 신호전달경로 (AKT, P38, JNK, Erk1/2 및 MEK)의 인산화를 모두 감소시키는 것을 확인하였다 (Fig. 3B). 특히, TNF-α 및 IL-1β의 조절이 12.5 ㎕/㎖ 눈연꽃 추출물 처리시 감소된 것과 Lyn과 Syk 인산화를 억제하는 농도가 같았기 때문에 두 인산화 억제를 통해 TNF-α 및 IL-1β의 조절이 관련이 있는 것으로 보인다.
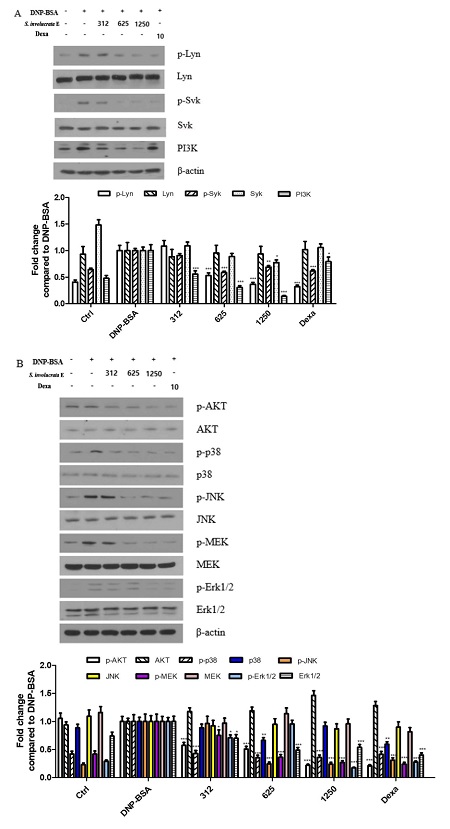
Effect of Saussurea involucrata (Kar. & Kir.) Sch. Bip. extract on protein phosphorylation in IgE-stimulated RBL-2H3 cells. The level of phosphorylation of Lyn, Syk, AKT, p38, JNK, MEK, Erk1/2, and PI3K was determined by western blot.(A); FcεRI pathway and PI3K signal control was determined by western blot analysis. (B); MAPK pathway was determined by western blot analysis. IgE-sensitized RBL-2H3 cells were preincubated with S. involucrata E, dexamethasone (10 μM) for 1 h before antigen treatment for 16 h. All values are the means ± S.D. of three independent experiments. β-actin was used as the loading control. All values were from three independent experiments. Values of *p < 0.05, **p < 0.01, and ***p < 0.001 were considered significantly different to the anti-DNP IgE plus DNP-BSA, One-way ANOVA and Bonferroni post-test.
PI3K에 관여하는 하위 시그널 중 Akt로 알려진 serine/threonine kinase의 종류인 PKD를 외부의 자극 및 세포내부의 신호를 조절하여 이를 통제하고 세포 증식과 생존을 조절하는 매개로 이용한다. 정상적인 Akt 신호는 세포를 증식하고, 인슐린과 DNA 손상 등에 의하여 활성화되어 세포막에서부터 네트워크 조절을 통해 생존에 관여한다 (Méndez-Pertuz et al., 2017). 반면, PKB에 의한 세포증식 조절은 세포사멸 (apoptosis)을 유도하거나 암세포를 활성화시키고, 염증자극을 유발시킨다. Mast 세포의 Akt 자극은 염증매개체를 통해 활성화되며, 이는 염증성 싸이토카인을 증가시키는 매개가 된다 (Ye et al., 2017). 이상의 결과를 통하여 눈연꽃 추출물의 처리가 rat 유래 mast 세포에서 자극된 Akt-MAPK를 감소시키고, 이를 통해 염증성 싸이토카인의 분비를 억제시킨다는 것을 확인하였다.
4. 눈연꽃 추출물의 F-actin 단백질 조절
세포는 이동 및 구조체를 유지하는 세포내 액틴-사이토스캘레톤 (actin-cytoskeleton)을 갖고 있는데, 이것은 세포의 모양을 유지하고, 극성을 유지시키며, 조직 재생과 밀접한 관련을 갖는다 (Baird and Holowka 2020). 포유류의 액틴은 단량체의 G-actin (globular actin, monomeric acitn)과 중합형인 F-actin (filamentous actin)의 형태로 존재하며, G-actin 형태는 생리학적 이온 농도의 변화에 따라 급속히 helical 형태로 중합되어 F-actin을 형성한다 (Kim et al., 2019). 이러한 구조적 변화는 구조의 안정성에 영향을 주고, 병원균이 숙주세포에 감염 시 이 같은 변화를 일으킨다.
F-actin 항체를 이용하여 FACS분석한 결과 IgE 반응 시 F-actin이 증가 3.94% 증가했고 (p < 0.001), 눈연꽃 추출물 처리시 312 ㎍/㎖ 처리군부터 농도의존적으로 F-actin이 감소되는 것을 확인했다 (p < 0.001, Fig. 4). 이 같은 결과는 세포 내 방어기전을 회복하는 변화로 볼 수 있으며, 눈연꽃 추출물이 IgE에 의해 발생된 염증을 완화시키고 세포를 정상으로 복구시키는 작용을 의미한다고 할 수 있다.
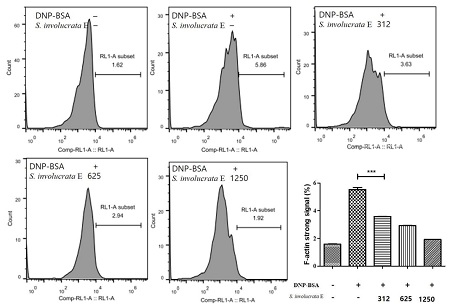
Effect of Saussurea involucrata (Kar. & Kir.) Sch. Bip. extract on F-actin expression in IgE-stimulated RBL-2H3 cells.The signal from the F-actin antibody conjugated to allophycocyanin (APC) was determined by flow cytometry analysis. All values were from three independent experiments. Values of ***p < 0.001 was considered significantly different to the anti-DNP IgE plus DNP-BSA, One-way ANOVA and Bonferroni post-test.
일부 추출물 중 용매별 극성도를 조절하여 화합물의 친화력을 조절한다. 식물추출 방법에는 일반적으로 물, 메탄올, 주정, 이소프로판올, 이산화탄소 및 에틸아세테이트를 가장 많이 사용하며 이는 식품의약품안정청 기능성 원료 표준화 지침서에 명기되어 있다.
폴리페놀은 수소 결합에 의하여 단백질과 복합체를 형성하기도 하는데, 폴리페놀은 효소 산화 반응에 민감하며 모든 식물에 존재하는 분리 과정 중에 소실되는 경우가 많으므로 폴리페놀을 추출할 때 효소 산화 반응을 억제하기 위해 끓는 메탄올 추출하는 방법을 채택하기도 한다.
또한, 플라보노이드의 경우 메탄올, 에탄올, 물 또는 이들을 조합하여 사용하여 추출 회수율을 높이거나 함량을 조절한다. 에탄올보다 메탄올이 더 극성이 강하며 메탄올이 더 친수성에 가깝고, 추출하는 물질의 극성도 범위도 메탄올이 에탄올 보다 넓기 때문에 극성물질은 100% 에탄올과 비교시 비슷한 물질로 추출되지만 비극성물질은 훨씬 다양하고 많이 추출될 수 있다. 다만, 메탄올이 신경독이기 때문에 상업적으로는 사용이 잘 되지는 않는다 (Zhang et al., 2000).
눈연꽃 추출물을 이용한 추출조건에 대한 연구는 없으나, 일부 논문을 토대로 추출시 추출조건에 대한 연구는 눈연꽃 추출물의 항염효과를 극대화 시킬 수 있을 것으로 보인다 (Lee et al., 2019). 특히, 케르세틴, 아피기닌, 헤스페리딘 및 루테올린과 같은 플라보노이드 함유는 항염증을 유도하는 효과가 있는 것으로 알려져 있어 눈연꽃 추출물의 추출조건에 따른 연구는 추출효율 및 원료 제조공정 표준화에 필요할 것으로 판단된다 (Pang et al., 2019; Guo et al., 2019; Lodhi et al., 2020; Tiboc-Schnell et al., 2020).
눈연꽃 추출물의 처리가 IgE 매개 RBL-2H3 세포의 염증자극을 완화하고, 염증성 싸이토카인을 억제시켜 FcεRI 신호를 조절하는 것을 확인하였다. 또한, F-actin을 안정화시켜 IgE 매개 면역자극을 정상화시켰다 (Fig. 5). 눈연꽃 추출물의 이 같은 매커니즘을 통해 염증억제제로 개발될 수 있는 기초를 제시하고자 한다.
References
-
Baird B and Holowka D. (2020). How does the actin cytoskeleton regulate distribution and diffusion of membrane components? Biophysical Journal. 118:15a. https://www.cell.com/biophysj/pdf/S0006-3495(19)31194-4.pdf, (cited by 2020 Oct 7).
[https://doi.org/10.1016/j.bpj.2019.11.265]

-
Bui T, Piao C, Song CH, Lee CH, Shin HS and Chai OH. (2017). Baicalein, wogonin, and scutellaria baicalensis ethanol extract alleviate ovalbumin-induced allergic airway inflammation and mast cell-mediated anaphylactic shock by regulation of th1/th2 imbalance and histamine release. Anatomy and Cell Biology. 50:124-134.
[https://doi.org/10.5115/acb.2017.50.2.124]

-
Bundgaard L, Sørensen MA, Nilsson T, Salling E and Jacobsen S. (2018). Evaluation of systemic and local inflammatory parameters and manifestations of pain in an equine experimental wound model. Journal of Equine Veterinary Science. 68:81-87.
[https://doi.org/10.1016/j.jevs.2018.05.219]

-
Draberova L, Draberova H, Potuckova L, Halova I, Bambouskova M, Mohandas N and Draber P. (2019). Cytoskeletal protein 4.1R is a positive regulator of the fcεri signaling and chemotaxis in mast cells. Frontiers in Immunology. 10:3068. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6970983/, (cited by 2020 Oct 14).
[https://doi.org/10.3389/fimmu.2019.03068]

-
Guo K, Ren J, Gu G, Wang G, Gong W, Wu X, Ren H, Hong Z and Li J. (2019). Hesperidin protects against intestinal inflammation by restoring intestinal barrier function and up-regulating treg cells. Molecular Nutrition and Food Research. 63:1800975. https://onlinelibrary.wiley.com/doi/full/10.1002/mnfr.201970058, (cited by 2020 Oct 30).
[https://doi.org/10.1002/mnfr.201800975]

-
Hagman S, Mäkinen A, Ylä-Outinen L, Huhtala H, Elovaara I and Narkilahti S. (2019). Effects of inflammatory cytokines ifn-γ, tnf-α and il-6 on the viability and functionality of human pluripotent stem cell-derived neural cells. Journal of neuroimmunology. 331:36-45.
[https://doi.org/10.1016/j.jneuroim.2018.07.010]

-
Hirzallah MI and Choi HA. (2016). The monitoring of brain edema and intracranial hypertension. Journal of Neurocritical Care. 9:92-104.
[https://doi.org/10.18700/jnc.160093]

-
Kawanishi S, Ohnishi S, Ma N, Hiraku Y and Murata M. (2017). Crosstalk between DNA damage and inflammation in the multiple steps of carcinogenesis. International Journal of Molecular Sciences. 18:1808. https://www.mdpi.com/1422-0067/18/8/1808, (cited by 2020 Oct 19).
[https://doi.org/10.3390/ijms18081808]

-
Kim JI, Park J, Ji Y, Jo KR, Han SM, Sohn JH, Shin KC, Han JS, Jeon YG, Nahmgoong H, Han KY, Kim JW, Kim S, Choe SS and Kim JB. (2019). During adipocyte remodeling, lipid droplet configurations regulate insulin sensitivity through F-actin and G-actin reorganization. Molecular and Cellular Biology. 39:e00210-19. https://mcb.asm.org/content/mcb/39/20/e00210-19.full.pdf, (cited by 2020 Oct 15).
[https://doi.org/10.1128/MCB.00210-19]

-
Kim SR, Heaton H, Liu L and King BA. (2018). Rapid repigmentation of vitiligo using tofacitinib plus low-dose, narrowband uv-b phototherapy. JAMA Dermatology. 154:370-371.
[https://doi.org/10.1001/jamadermatol.2017.5778]

-
Kim YY, Je IG, Kim MJ, Kang BC, Choi YA, Baek MC, Lee BH, Choi JK, Park HR, Shin TY, Lee SY, Yoon SB, Lee SR, Khang DW and Kim SH. (2017). 2-hydroxy-3-methoxybenzoic acid attenuates mast cell-mediated allergic reaction in mice via modulation of the fcεri signaling pathway. Acta Pharmaceutica Sinica. 38:90-99.
[https://doi.org/10.1038/aps.2016.112]

-
Kong ZL, Sudirman S, Lin HJ and Chen W. (2020). In vitro anti-inflammatory effects of curcumin on mast cell-mediated allergic responses via inhibiting fcεri protein expression and protein kinase c delta translocation. Cytotechnology. 72:81-95.
[https://doi.org/10.1007/s10616-019-00359-6]

-
Larsen LF, Juel-Berg N, Hansen KS, Clare Mills EN, van Ree R, Poulsen LK and Jensen BM. (2018). A comparative study on basophil activation test, histamine release assay, and passive sensitization histamine release assay in the diagnosis of peanut allergy. Allergy. 73:137-144.
[https://doi.org/10.1111/all.13243]

-
Lee YM, Kim IS, Kim JG, Park SH and Lim BO. (2019). Antioxidative, anti-inflammatory, and DNA damage protective effect in cortex extracts of eucommia ulmoides by roasting. Korean Journal of Medicinal Crop Science. 27:259-270.
[https://doi.org/10.7783/KJMCS.2019.27.4.259]

-
Lin K, Huang D, Huang D, Tzeng S and Lin W. (2016). Inhibition of ampk through lyn-syk-akt enhances fcεri signal pathways for allergic response. Journal of Molecular Medicine. 94:183-194.
[https://doi.org/10.1007/s00109-015-1339-2]

-
Liou C, Wu S, Chen L, Yeh K, Chen C and Huang W. (2017). Acacetin from traditionally used saussurea involucrata kar. Et kir. Suppressed adipogenesis in 3t3-l1 adipocytes and attenuated lipid accumulation in obese mice. Frontiers in Pharmacology. 8:589. https://www.frontiersin.org/articles/10.3389/fphar.2017.00589/full, (cited by 2020 Oct 29).
[https://doi.org/10.3389/fphar.2017.00589]

-
Lodhi S, Vadnere GP, Patil KD and Patil TP. (2020). Protective effects of luteolin on injury induced inflammation through reduction of tissue uric acid and pro-inflammatory cytokines in rats. Journal of Traditional and Complementary Medicine. 10:60-69.
[https://doi.org/10.1016/j.jtcme.2019.02.004]

-
Méndez-Pertuz M, Martínez P, Blanco-Aparicio C, Gómez-Casero E, García AB, Martínez-Torrecuadrada J, Palafox M, Cortés J, Serra V, Pastor J and Blasco MA. (2017). Modulation of telomere protection by the pi3k/akt pathway. Nature Communications. 8:1278. https://www.nature.com/articles/s41467-017-01329-2, (cited by 2020 Oct 2).
[https://doi.org/10.1038/s41467-017-01329-2]

- Pang L, Zou S, Shi Y, Mao Q and Chen Y. (2019). Apigenin attenuates pm2.5-induced airway hyperresponsiveness and inflammation by down-regulating NF-κB in murine model of asthma. International Journal of Clinical and Experimental Pathology. 12:3700-3709.
-
Park JB, Youn DH, Kang JW, Ahn KS, Kwak HJ and Um JY. (2019). Taeumjowi-tang, a traditional korean Sasang remedy, improves obesity-atopic dermatitis comorbidity by regulating hypoxia-inducible factor 1 alpha. Frontiers in Pharmacology. 10:1458. https://www.frontiersin.org/articles/10.3389/fphar.2019.01458/full, (cited by 2020 Oct 2).
[https://doi.org/10.3389/fphar.2019.01458]

-
Patruno A, Ferrone A, Costantini E, Franceschelli S, Pesce M, Speranza L, Amerio P, D'angelo C, Felaco M, Grilli A and Reale M. (2018). Extremely low-frequency electromagnetic fields accelerates wound healing modulating MMP-9 and inflammatory cytokines. Cell Proliferation. 51:e12432. https://onlinelibrary.wiley.com/doi/full/10.1111/cpr.12432, (cited by 2020 Oct 2).
[https://doi.org/10.1111/cpr.12432]

-
Seresirikachorn K, Chitsuthipakorn W, Kanjanawasee D, Khattiyawittayakun L and Snidvongs K. (2019). Leukotriene receptor antagonist addition to H1-antihistamine is effective for treating allergic rhinitis: A systematic review and meta-analysis. American Journal of Rhinology and Allergy. 33:591-600.
[https://doi.org/10.1177/1945892419844459]

- Štromberga Z, Chess-Williams R and Moro C. (2017). The role of histamine in modulating urothelial contractile activity. Australian and New Zealand Continence Journal. 23:112-112.
-
Tabakawa Y, Ohta T, Yoshikawa S, Robinson EJ, Yamaji K, Ishiwata K, Kawano Y, Miyake K, Yamanishi Y, Ohtsu H, Adachi T, Watanabe N, Kanuka H and Karasuyama H. (2018). Histamine released from skin-infiltrating basophils but not mast cells is crucial for acquired tick resistance in mice. Frontiers in Immunology. 9:1540. https://www.frontiersin.org/articles/10.3389/fimmu.2018.01540/full, (cited by 2020 Oct 3).
[https://doi.org/10.3389/fimmu.2018.01540]

-
Tannert LK, Falkencrone S, Mortz CG, Bindslev-Jensen C and Skov PS. (2017). Is a positive intracutaneous test induced by penicillin mediated by histamine? A cutaneous microdialysis study in penicillin-allergic patients. Clinical and Translational Allergy. 7:40. https://link.springer.com/article/10.1186/s13601-017-0179-2, (cited by 2020 Oct 17).
[https://doi.org/10.1186/s13601-017-0179-2]

- Tiboc-Schnell CN, Filip GA, Man SC, Decea N, Moldovan R, Opris R, Sas V and Tabaran F. (2020). Quercetin attenuates naso-sinusal inflammation and inflammatory response in lungs and brain on an experimental model of acute rhinosinusitis in rats. Journal of Physiology and Pharmacology. 71:479-490.
-
Wang P, Henning SM and Heber D. (2010). Limitations of mtt and mts-based assays for measurement of antiproliferative activity of green tea polyphenols. PloS one. 5:e10202. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0010202, (cited by 2020 Oct 16).
[https://doi.org/10.1371/journal.pone.0010202]

-
Wang R, Liu J, Liu S, Guan S and Jiao P. (2020). Characterization of the complete chloroplast genome of saussurea involuerata(compositae), an endangered species endemic to china. Mitochondrial DNA Part B Resources. 5:511-512.
[https://doi.org/10.1080/23802359.2019.1705195]

-
Xu N and An J. (2017). Formononetin ameliorates mast cell-mediated allergic inflammation via inhibition of histamine release and production of pro-inflammatory cytokines. Experimental and Therapeutic Medicine. 14:6201-6206.
[https://doi.org/10.3892/etm.2017.5293]

-
Ye J, Piao H, Jiang J, Jin G, Zheng M, Yang J, Jin X, Sun T, Choi YH and Li L. (2017). Polydatin inhibits mast cell-mediated allergic inflammation by targeting PI3K/Akt, MAPK, NF-κB and Nrf2/HO-1 pathways. Scientific Reports. 7:11895. https://www.nature.com/articles/s41598-017-12252-3, (cited by 2020 Oct 10).
[https://doi.org/10.1038/s41598-017-12252-3]

-
Zhang L, Sun L, Zhang L, Qiu H, Liu C, Wang A, Deng F and Zhu J. (2017). A Cu/Zn superoxide dismutase gene from Saussurea involucrata Kar. & Kir., SICSD, enhances drought, cold, and oxidative stress in transgenic tobacco. Canadian Journal of Plant Science. 97:816-826.
[https://doi.org/10.1139/CJPS-2016-0180]

-
Zhang W, Bevins MA, Plantz BA, Smith LA and Meagher MM. (2000). Modeling Pichia pastoris growth on methanol and optimizing the production of a recombinant protein, the heavy-chain fragment C of botulinum neurotoxin, serotype A. Biotechnology and Bioengineering. 70:1-8. https://www.ncbi.nlm.nih.gov/pubmed/10940857, (cited by 2020 Oct 3).
[https://doi.org/10.1002/1097-0290(20001005)70:1<1::AID-BIT1>3.0.CO;2-Y]