서양금혼초 부위별 추출물의 티로신에이즈, α-글루코시다아제 저해활성 및 항산화효과
†Corresponding author: +82-64-754-3314 aha2011@jejunu.ac.kr
© The Korean Society of Medical Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Invasion of these invasive plants in the ecosystem threatens the habitat of endemic species, reduces biodiversity, and causes a disturbance in the ecological system. Hypochaeris radicata L. (Asteraceae), the most invasive plant in Korea, particularly in Jeju Island, invades farmlands, and autochthonous forests, resulting in the establishment of monocultures and modification of the ecosystem structure.
In this study was, we evaluated the biological activity of 70% ethanolic extracts from different parts of Hypochaeris radicata L. The biological activities of 70% ethanolic extracts of different parts, such as flower, leaf, stem, and root, of H. radicata were investigated. The total polyphenol content was highest in flower extracts (50.82 ± 3.16 ㎎ · GAE/g). In addition, the highest flavonoid content was observed in flower extract (15.19 ± 2.03㎎ · QE/g). The flower extract of H. radicata exhibited stronger DPPH radical-scavenging activities, ABTS radical scavenging activities, and reducing power than the other parts. The flower extract of H. radicata was observed to have the highest tyrosinase and α-glucosidase inhibitory activities.
The flower extracts of H. radicata exhibited remarkable antioxidant activity as well as tyrosinase and α-glucosidase inhibitory effects. These activities might be related to the phenolic compounds present in the H. radicata flower extract.
Keywords:
Hypochaeris radicata L, ABTS Radical Scavenging Activity, Different Part, Flower, Invasive Exotic Species서 언
활성산소는 호흡 및 대사과정에서 사용되어진 산소로부터 생성되며 세포의 기능유지에 중요한 역할을 하기도 하지만, 내 부적인 요인이 아닌 오염물질이나 화학물질에 대한 노출, 스 트레스 등과 같은 외부적인 요소들에 의하여 생성량이 증가한 다 (Finkel, 2011). 생체 내 활성 산소를 제거하는 시스템의 항산화 시스템 기능이 약화되는 경우 활성산소에 의해서 세포 막, DNA, 단백질 등 생체 구성 물질의 손상 및 만성적 염증 반응을 유발하여 심혈관계 질환이나 자가면역 질환 등을 촉진 한다고 보고하였다 (Valko et al., 2007).
최근 들어 활성산소로 인한 만성 염증 반응이 항산화제에 의해 억제되는 것이 알려지면서 천연물로부터 항산화 활성 및 항염증 활성을 가지는 물질을 찾기 위한 연구가 꾸준히 진행 되고 있다. 식물에는 특유의 항산화 활성을 가지는 물질들이 존재하며 이들 대부분은 페놀성 히드록실기를 가지는 화합물 들이며, 페놀성 히드록실 그룹은 활성산소를 소거하는데 있어 서 중요한 역할을 한다고 알려져 있다. 이러한 페놀성 화합물 들은 식물들이 스트레스에 대한 방어 역할 물질로 생산하는 2 차 대사산물들로써 항산화, 항염증, 항암 활성 등과 같은 다양 한 생리 기능성을 가진다고 알려져 있다 (Rahman et al., 2006).
귀화 식물이란 학자들 간 다소 차이는 있으나, 의도적 혹은 비의도적으로 원래의 생육지에서 벗어나 다른 지역으로 이입 되어진 식물을 지칭하며 정착되어진 생태계에서 도태되지 않 고 토착하여 살아가는 외래 식물들을 지칭한다 (Park, 1994).
서양금혼초 (Hypochaeris radicata L.)는 원산지가 유럽인 국화과 식물로 개민들레라고 부르기도 하며, 1980년대에 제주 를 비롯한 국내에 들어온 뒤 목장 등에 퍼져 자라서 풀밭을 황폐하게 만들고 있다. 서양금혼초는 서식 특성상 잎이 바닥 에 바짝 붙어 방사형으로 퍼지기 때문에 밀식해서 자랄 경우 에는 다른 식물의 생육환경을 저해하게 된다. 특히 봄부터 가 을에 걸쳐 1 개체당 최대 1만 개 가량의 종자를 맺음으로써 매우 빠르게 전파되고 있다. 이러한 연유로 서양금혼초는 가 시박, 애기수영, 미국쑥부쟁이, 양미역취와 함께 생태계 교란 야생식물로 2009년 6월 1일 지정, 관리되고 있다. 특히 제주 지역은 국제관광도시로 물적 교류가 활발해지면서 귀화식물이 크게 증가하고 있으며, 제주도 조사에서 귀화식물은 1914년 25 종, 1993년 45 종, 1998년 188 종, 2005년 199 종으로 크게 늘어나고 있는 추세이다 (Jung, 2014). 특히 서양금혼초 ( 개민들레), 서양민들레, 도꼬마리, 돼지풀, 흰독말풀, 메귀리 등 도내 귀화식물 41 종이 환경부로부터 위해식물로 지정되는 등 전체 20.6%를 차지하고 있다. 귀화식물들은 제주국제공항과 항 만, 주요 도로변, 공한지를 비롯해 중산간 초지 등에 무차별적 으로 정착해 서식하고 있다. 곶자왈 지대와 한라산 백록담까지 도내 전역으로 확산하면서 제주토종식물을 제치고 생태계 우위 를 점하는 등 악영향을 미치고 있다 (Yang and Kim, 2002).
이러한 생태계 교란식물인 서양금혼초의 이용성을 증가시키 기 위하여 다양한 연구가 최근 들어 진행되어지고 있다. 서양 금혼초 추출물은 항암활성 (Bohlmann and Bohlmann, 1980), 미백활성 (Lee et al., 2005), 항균활성 (Maruta et al., 1995), 항염활성 (Kim et al., 2014) 등이 있다고 알려져 있 다. 서양금혼초의 뿌리와 잎에 대한 용매별 추출물의 항산화 활성이 보고되어져 있으나 (Senguttuvan et al., 2014), 지상부 의 줄기, 잎 그리고 꽃 부분으로 나누어 연구한 연구는 보고 되어 있지 않다. 따라서 본 연구에서는 토착생태계를 파괴하 는 생태계 교란식물인 서양금혼초의 활용 방안을 증진시켜 서 양금혼초 제거 및 활용에 도움이 될 기초 연구로써 서양금혼 초 부위별 추출물을 제조하여 추출물의 항산화 활성을 조사함 으로써 서양금혼초 추출물의 화장품원료로서의 활용 가능성을 탐색하기 위하여 수행하였다.
재료 및 방법
1 재료
서양금혼초 (Hypochaeris radicata L.)의 각 부위 (꽃, 뿌리, 잎, 줄기)는 2016년 5월경 제주대학교 생명자원과학대학 본관 뒤편에서 직접 채집하였다. 이물질들을 세척하여 제거한 후 열 풍 건조기를 이용하여 50℃의 온도에서 건조시켰다. 이후 각 부위를 분쇄기를 이용하여 분쇄하고 0.5㎜ 체를 이용하여 걸 러내었다. 이렇게 걸러진 시료는 중량 20 배의 70% 에탄올을 가한 뒤 초음파추출기 (Power sonic 520, Hwashin Technology Co., Seoul, Korea)를 사용하여 90 분씩 3 회 반복하여 추출 하고 여과하였다. 여과한 추출물들을 감압농축기 (Hel-VAP Precision, Heidolph Instruments GmbH and Co., KG, Schwabach, Germany)로 농축시킨 다음 동결 건조하여 실험에 사용하였다.
2 총 phenol성 화합물 함량 측정
서양금혼초 부위별 추출물의 phenol성 화합물은 Folin-Denis 방법을 변형하여 측정하였다 (Singleton et al., 1999). 각 시 료 추출물 20㎕를 넣고 증류수 700㎕을 혼합시킨다. 이후 Folin-Ciocalteu 시약 100㎕를 넣어 2 시간 반응시키고 20% sodium carbonate를 100㎕씩 가한다. 1 시간 동안 방치한 후 에 i-Mark Microplate Reader (168-1135, Bio-Rad, Hercules, CA, USA)를 사용하여 750㎚에서 흡광도를 측정하였다. 추출 물의 흡광도는 gallic acid로 작성한 표준검량곡선을 이용하여 GAE (gallic acid equivalent)로 나타냈다.
3 총 flavonoid 함량 측정
서양금혼초 부위별 추출물의 flavonoid 함량은 식품의약품 안전청의 식품공전에 게재된 방법을 변형하여 측정하였다 (Kim et al., 2012). 각 시료 추출물 100㎕를 넣고 EtOH을 300㎕ 가한 후 10% aluminum nitrate 20㎕와 1M potassium acetate 20㎕를 혼합하고 증류수를 560㎕ 가하여 1 시간 동안 반응시킨다. 이후 Microplate Reader를 사용하여 417㎚에서 흡광도를 측정하였다. 추출물의 흡광도는 quercetin 을 이용하여 QE (quercetin equivalent)로 나타내었다.
4 DPPH radical 소거능 측정
Radical 소거활성 측정은 안정한 상태로 존재하는 1,1- diphenyl-2-picrylhydrazyl (DPPH)을 사용하여 Blois (1958)의 방법을 변형하여 측정하였다. 부위별 추출물의 DPPH 활성 저 해율을 측정하기 위해 sample 40㎕에 0.15 mM DPPH 용액 을 160㎕ 가하여 암실에서 30 분 반응시키고 Microplate Reader를 사용하여 흡광도를 490 ㎚에서 측정하였다. 계산식 은 DPPH radical scavenging activity(%) = [1-(absorbance of the sample-absorbance of the blank) / absorbance of the control] × 100 로 나타내었다.
5 ABTS radical 소거능 측정
Kim 등 (2016)의 방법을 변형하여 ABTS radical 소거능을 측정하였다. 7mM ABTS [2.2-azino-bis(3-ethylbenzo-thiazoline- 6-sulphonicacid)]와 2.45mM potassium persulfate를 혼합하여 24 시간 방치한 후 실험 전에 750㎚에서 흡광도가 0.70 ± 0.02가 되도록 증류수로 희석하여 사용하였다. 혼합용액 160㎕에 희석한 sample 40㎕를 가하여 5 분간 반응시키고 Microplate Reader를 사용하여 흡광도를 측정하였다.
6 환원력 측정
서양금혼초 부위별 추출물의 환원력은 Fe3+ 이온에서 Fe2+ 이온으로 환원하는 능력을 비색법에 의해 측정하였다 (Hyun et al., 2014). 1% potassium ferricyanide 500㎕와 0.2M sodium phosphate buffer (pH 6.6) 500㎕를 혼합한 뒤 25 - 200㎍/㎖ 농도의 부위별 추출물을 가하여 50℃에서 반 응하였다. 20 분 뒤 10% trichloroacetic acid 2.5㎖ 넣어 반 응을 정지하였다. 이후 상등액을 500㎕ 취하고 증류수 500㎕ 더하여 희석하였다. 희석한 상등액에 0.1% ferric chloride를 100㎕ 가하고 UV-spectrometer (UV-1800, Shimadzu, Kyoto, Japan)로 700㎚에서 흡광도를 측정하였다.
7 Tyrosinase 저해활성 측정
Tyrosinase 저해활성은 tyrosine을 기질로 사용하여 tyrosinase에 의해서 생성된 dopachrome의 양을 비색법에 의해 측정하였다 (Yoon et al., 2009). 1 mM L-tyrosine, 50 mM potassium phosphate buffer (pH 6.5)와 증류수를 10 : 10 : 9 비율로 혼합한 혼합액 170㎕에 부위별 추출물 10 ㎕ 와 1 KU/㎖ tyrosinase from mushroom 20㎕을 가하고 37℃에서 15 분간 반응시킨 후 Microplate Reader를 사용하여 490㎚에 서 흡광도를 측정하여 추출물의 농도별 (0.1 - 3.0㎎/㎖)로 저 해율을 계산한 다음 50% 저해활성 농도인 inhibitory concentration 50 (IC50)을 구하여 tyrosinase 저해활성을 평가 하였다.
8 α-Glucosidase 저해활성 측정
α-Glucosidase에 대한 저해활성을 측정하기 위해 pnitrophenyl α-D-glucopyranoside (pNPG)를 이용하여 측정하 였다 (Kim and Kim, 2016). 각 부위별 추출물 20㎕에 20 mM potassium phosphate buffer (pH 6.8) 120㎕와 0.5 U/㎖ α-glucosidase 50 ㎕를 가하여 37℃에서 10 분 동안 방치한다. 이후 2 mM pNPG 10㎕를 가하여 37℃에서 30 분간 반응시켰다. 혼합액에 100 mM sodium carbonate 100㎕를 넣어 반응을 정지시키고 흡광도를 UV-spectrometer 를 사용하여 405㎚에서 흡광도를 측정하여 추출물의 농도별 (0.25 - 1.00㎎/㎖)로 저해율을 계산한 다음 50% 저해활성 농 도를 구하여 α-glucosidase 저해활성을 평가하였다.
9 통계분석
본 연구의 실험 결과는 평균 ±표준편차로 나타내었으며, 각 실험군의 통계처리는 SPSS (Statistical Package for the Social Sciences, ver. 18.0, SPSS Inc., Chicago, IL, USA) 를 사용하여 분산분석을 실시하였으며 유의적 차이가 있는 항 목에 대해서는 Tukey의 다중범위검정 (Tukey Multiple Range Test, TMRT)을 이용하여 통계학적 유의성을 분석하였다 (p < 0.05).
결과 및 고찰
1 총 페놀성 화합물 및 flavonoid 함량
폴리페놀이란 한 분자 내에 2개 이상의 페놀성 히드록실 그 룹을 가지는 방향족 화합물들이며 caffeic acid와 같은 phenolic acid 및 kaempferol 및 cathechin과 같은 flavonoid 계열의 화합물들로 분류 가능하다. 이들 폴리페놀성 물질들은 항산화, 항염 및 항암 활성 등과 같은 다양한 생리 활성을 가 지며, 식물의 2 차 대사산물로 알려져 있다 (Manach et al., 2004).
서양금혼초 (Hypochaeris radicata L.) 부위별 추출물의 폴 리페놀 및 flavonoid 분석결과, 폴리페놀 함량은 flower에 서 가장 높았으며 flower (50.82 ± 3.16㎎) > stem (30.54 ± 32.54㎎) > root (24.27 ± 0.77㎎) > leaf (22.12 ± 0.65㎎)의 순이었다. Flavonoid의 경우 total phenol성 화합물과 비슷하게 flower에서 가장 높았으며 flower (15.19 ± 2.03㎎) > stem (10.41 ± 0.40㎎) > leaf (9.31 ± 0.72㎎) > root (4.39 ± 0.20㎎) 순이었다 (Table 1).

Total phenol and flavonoid contents of 70% ethanol extracts from Hypocahaeris radicata flower, leaf, stem and root.
Senguttuvan 등 (2014)에 의하면 서양금혼초 잎 및 뿌리 부 분의 항산화 활성 연구에서 본 연구의 잎 부분 및 뿌리 부분 과 비슷하게 폴리페놀 성분은 모든 용매 추출물에서 뿌리보다 높은 폴리페놀 함유량을 나타내었으며, flavonoid 함량의 경우 에는 잎 부분 추출물이 뿌리 추출물보다 높은 함량을 나타내 었다. 폴리 페놀성 화합물의 항산화 능력은 페놀성 히드록실 그룹과 전자가 부족한 프리 라디칼과 반응하여 전자를 제공함 으로서 항산화 능력을 가진다고 알려져 있다. 또한 다양한 식 물 추출물의 항산화 활성은 페놀성 화합물의 함량과 유의적인 관계를 가진다고 연구되어있다 (Kaur and Kapoor, 2002).
2 DPPH radical 소거능
DPPH radical은 분자 내에 전자가 부족한 화합물로 항산화 활성을 가지는 물질로부터 전자를 전달받아 radical이 소거되 는 원리를 이용하여 항산화 물질의 전자 공여능력을 측정할 수 있는 간단한 방법이다. 서양금혼초 부위별 추출물의 DPPH radical 소거능은 모든 추출물에서 농도 의존적으로 소거활성 이 증가하였다 (Fig. 1). Flower 추출물의 경우 DPPH radical 소거활성이 가장 높았으며 대조군인 BHT와 유사한 소 거활성을 나타내었으며 flower > stem > root > leaf의 순서로 소 거 활성이 감소하였다.
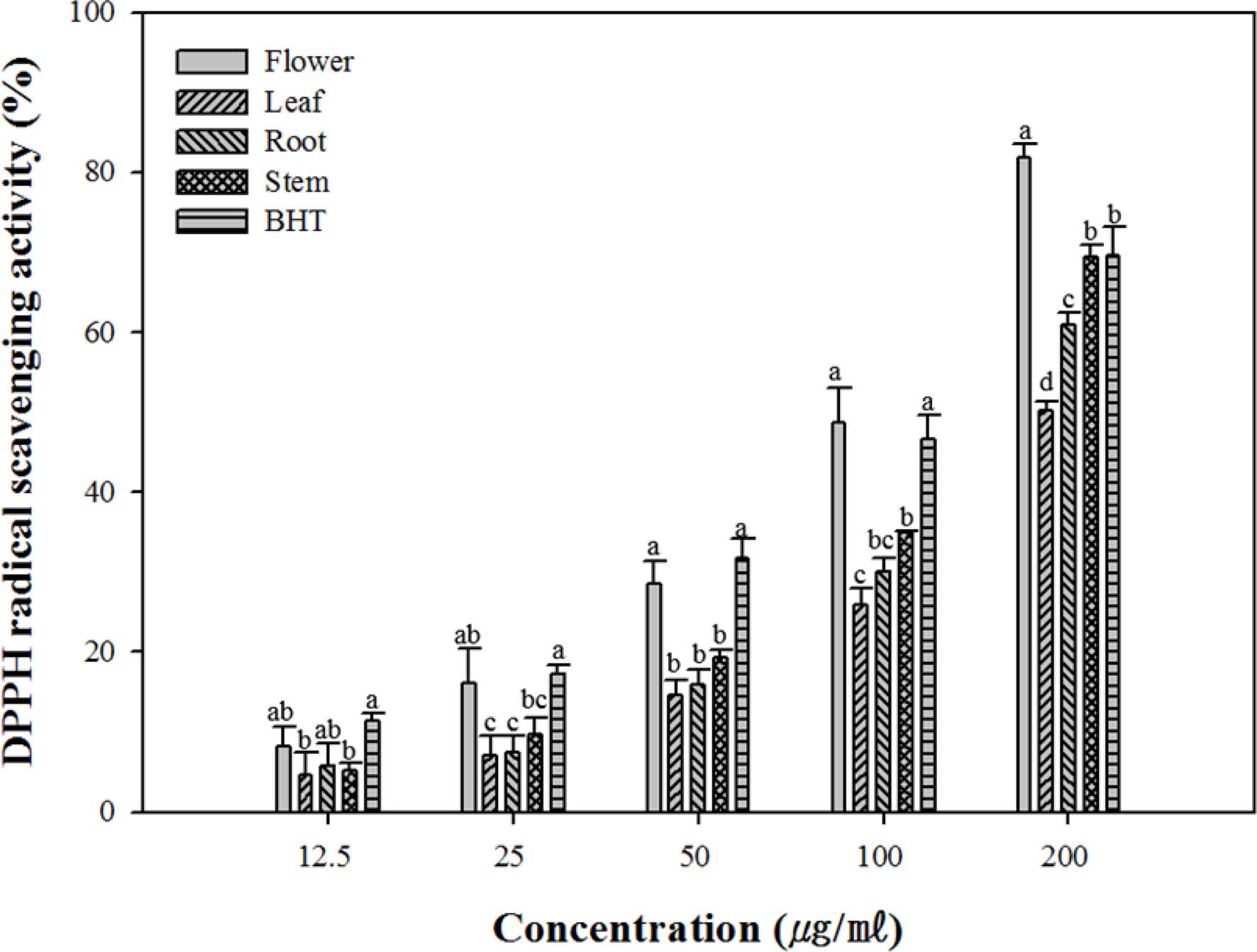
DPPH radical scavenging activity of 70% ethanol extracts from Hypochaeris radicata flower, leaf, stem and root. *Means with different letters (a - d) in the same column are significantly different at TMRT (p < 0.05).
Senguttuvan 등 (2014)에 의하면 서양금혼초 잎 및 뿌리 부 분의 용매별 추출물의 항산화 활성 연구에서 추출물 중에서 flavonoid의 함량이 높은 추출물일수록 본 연구와 유사하게 DPPH radical 소거능이 증가함을 나타내었다. 또한, Chon 등 (2012)은 서양민들레 부위별 추출물의 항산화 활성 연구에 의 하면 total polyphenol 및 flavonoid의 함량은 flower 추출물 이 가장 높았으며 leaf, root, stalk 추출물 순으로 감소하였으 며 DPPH radical 소거능 또한 flower 추출물이 가장 높으며 leaf, root, stalk 추출물 순으로 감소한다고 보고하였다. 이는 Zhou와 Yu 등 (2006)이 보고한 연구에서도 여러 가지 채소 추출물의 페놀 함량은 DPPH radical 소거능과 상관관계가 있 다는 보고와 일치하며 폴리페놀이 식물체의 항산화성에 주요 한 역할을 할 수 있음을 보여주고 있는 결과이다.
3 ABTS radical 소거능
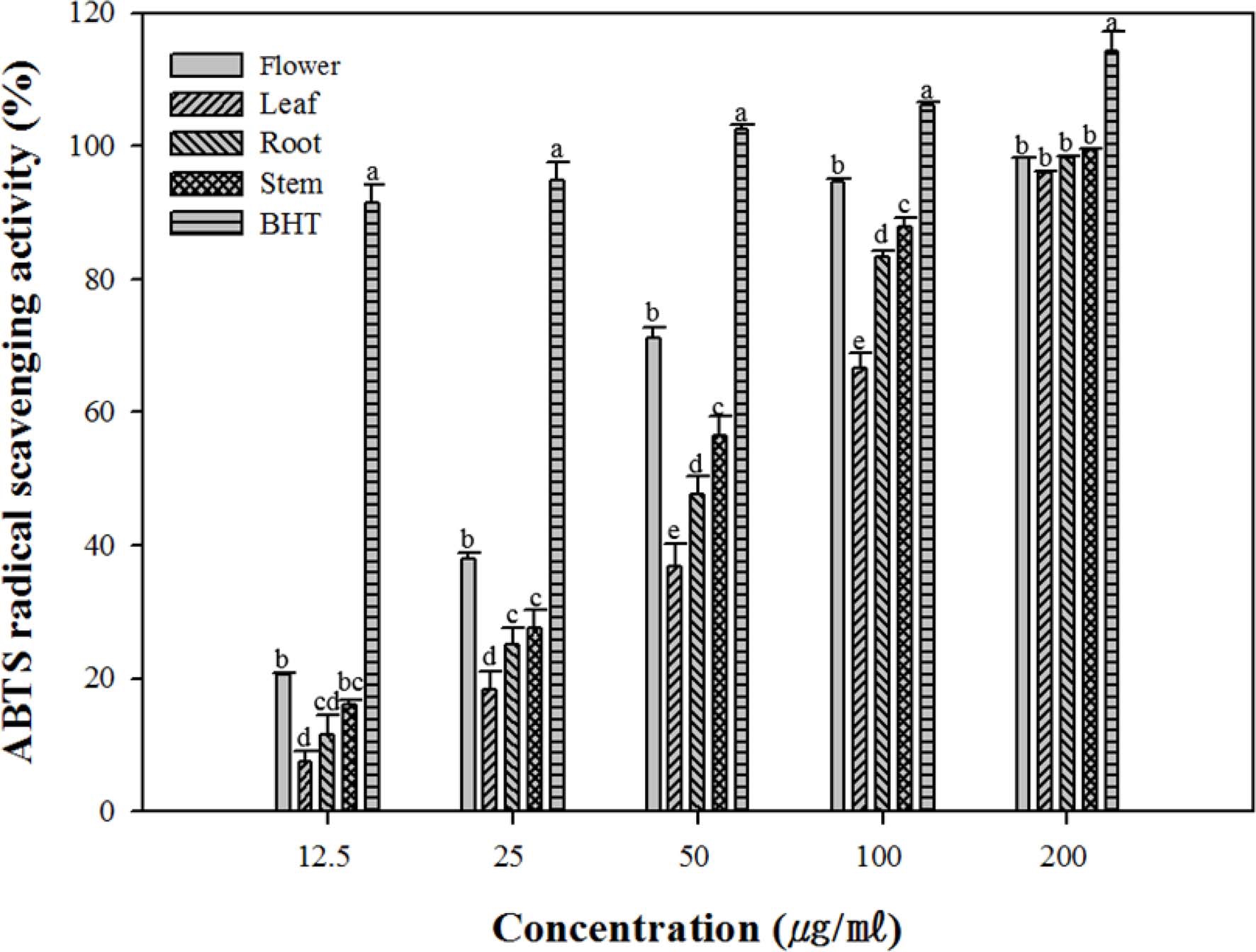
안정된 ABTS와 과산화물과의 반응으로 생성된 ABTS+ 라 디칼에 항산화물이 수소원자 또는 전자를 제공하여 ABTS+ 라 디칼을 소거시키는 능력을 측정하였다. 모든 부위별 추출물에 서 농도 의존적으로 소거능이 증가하였다.
각각의 추출물에서 소거능은 flower 추출물의 경우 가장 높 은 소거능을 나타내었으며 DPPH radical 소거능처럼 flower > stem > root > leaf 순으로 감소하였다 (Fig. 2). 이는 Maisuthisakul 등 (2007)이 연구한 식물 추출물의 다양한 radical 소거능에 대해서 연구한 결과에서 나타난 바와 같이 추출물의 radical 소거능은 추출물에 함유된 polyphenol 함량 과 밀접한 관계를 가지며, 또한 Rice-Evans 등 (1996)이 연구 한 다양한 phenolic aicd의 radical 소거능 측정에서도 페놀성 히드록실 그룹은 radical에 수소원자 또는 전자를 빠르게 제공 하여 radical을 안정화 시킨다고 하였으며 본 연구에서도 폴리 페놀 및 플라보노이드의 함량이 높은 flower 추출물의 소거능 이 가장 좋음을 알 수 있었다.
4 환원력
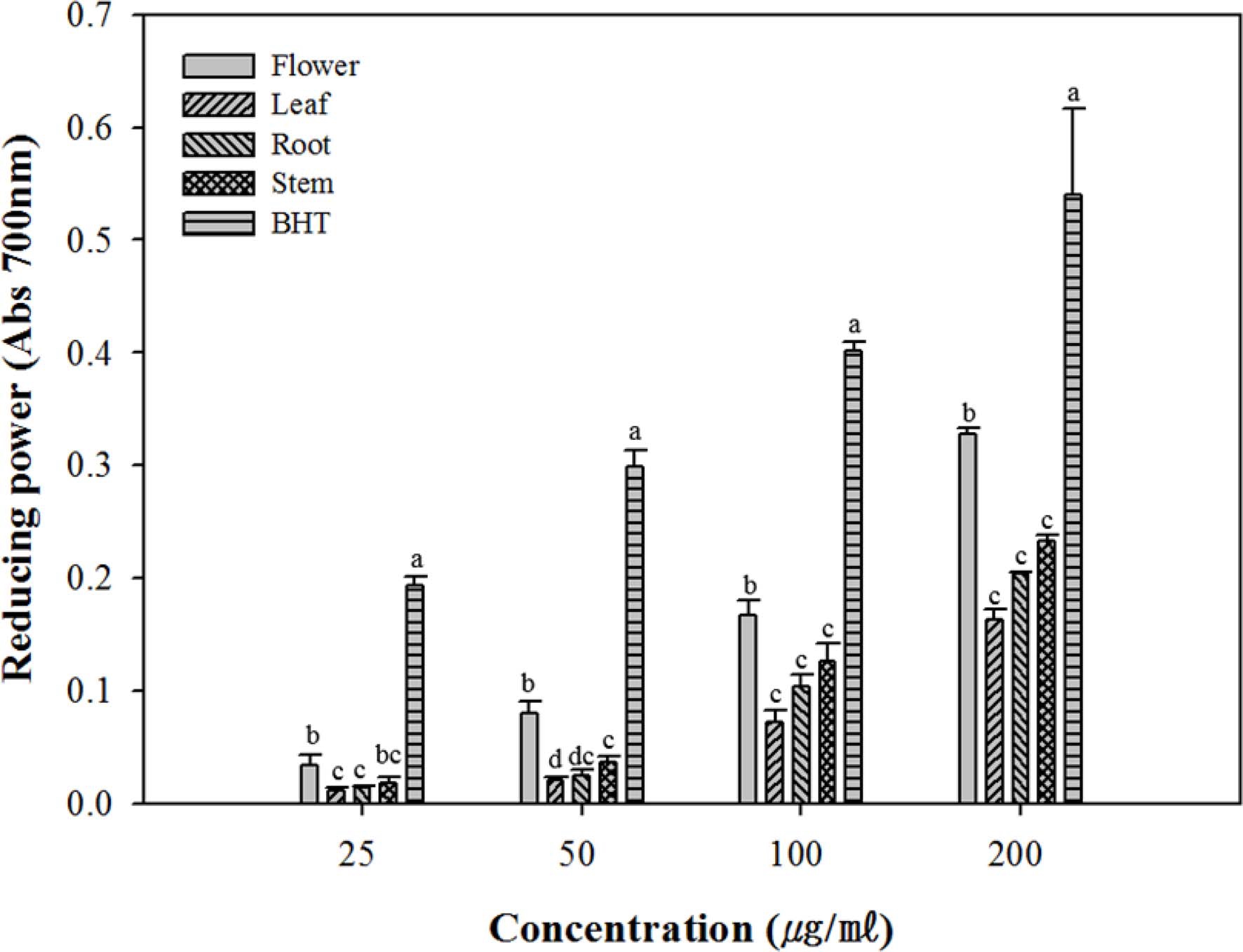
환원력은 일반적으로 항산화 활성을 가지는 물질의 전자 전 달 능력을 측정하여 항산화 능력을 평가하는 방법으로 항산화 활성을 가지는 물질이 ferricyanide 혼합물의 3가 철을 2가 철 로 전환시킨다. 즉 노란색에서 녹색으로 변하는 프러시안 블 루 생성원리를 응용한 것으로 높은 흡광도 값을 나타내면 항 산화 활성이 우수하다고 평가할 수 있다.
측정된 샘플의 환원력은 모두 농도가 증가함에 따라 흡광도 값이 증가하였다. 전체적으로 BHT에 비해 낮은 환원력을 가 지고 있었지만 서양금혼초 부위별 추출물 중 flower 추출물이 가장 높은 환원력을 나타내었고 flower 추출물, stem 추출물, root 추출물, leaf 추출물 순의 전자공여능과 유사한 활성을 나 타내었다 (Fig. 3).
5 Tyrosinase 저해활성
Melanine은 세포 내 소기관인 리보솜에서 tyrosinase의 생합 성에서 합성되기 시작한다. Tyrosinase는 피부 세포내에 존재 하는 tyrosine을 산화시켜서 melanine 생성경로에서 필수적인 역할을 하는 효소이며, 이러한 tyrosinase 활성을 저해하여 멜 라닌 생성에 필수적인 역할을 하는 dopaquinone의 생성량을 감소시켜 멜라닌 생성을 억제시킴으로써 피부 미백용 기능성 화장품 원료 개발의 타깃으로 인정되고 있다 (Prota, 1993).
서양금혼초 부위별 추출물의 tyrosinase 저해활성은 항산화 활성 실험 및 total phenol 및 flavonoid 함량 결과처럼 flower 추출물에서 가장 높은 저해 활성 (691.00 ± 79.53㎍/㎖) 을 나타내었으며 stem 추출물 (2,099.90 ± 219.80㎍/㎖), root 추출물 (2,964.40 ± 219.20㎍/㎖), leaf 추출물 (> 3,000㎍/㎖) 순으로 활성이 감소하였다 (Table 2).

Tyrosinase inhibitory activity of 70% ethanol extracts from Hypocahaeris radicata flower, leaf, stem and root.
Lee 등 (2005)은 서양금혼초 지상부의 피부 미백활성에 대 한 연구에서 tyrosinase 저해활성은 나타나지 않으나 피부 멜 라노마세포에서 멜라닌 생성을 억제하여 미백활성을 가진다고 보고하였으며, 또한 흰민들레 추출물 및 분획물에 대한 tyrosinase 저해활성에 대한 연구에서는 추출물의 경우 tyrosinase 저해활성은 약하나, 페놀성 화합물이 풍부한 에틸아 세테이트 분획의 경우에는 저해 활성이 증가하였다고 보고하 였다 (Im and Lee, 2011). 이러한 결과는 Gulua 등 (2002) 이 보고한 바와 같이 각 식물의 잎에서 추출된 페놀화합물 성 분이 tyrosinase 기질인 tyrosine과 구조적으로 유사하여 효소 활성을 저해한다는 결과로 추정된다.
6 Glucosidase 저해 활성
당뇨병은 인슐린 의존형인 1형과 인슐린 비의존형 2형 당뇨 로 나눌 수 있으며, 현재 전체 당뇨병 환자의 90% 정도가 제 2형 당뇨병에 해당한다고 조사되고 있다 (Saudek and Eder, 1979). 2형 당뇨병의 치료는 주로 약물을 이용하여 혈당을 강 하시키는 혈당강하제를 사용한다. 식이를 통하여 흡수된 탄수 화물을 단당류로 분해시키는 작용을 하는 효소인 α- glucosidase는 체내로 흡수된 탄수화물 분해를 소장에서 억제 하여, 급격한 혈당의 상승을 막는 방법이다. 그러나 현재 처방 중인 acarbose와 voglibose 등의 α-glucosidase 저해제를 장기 간 복용할 경우 부작용을 나타낼 수 있어 (Hanefeld, 1998), 천연 식물 자원에서 새로운 혈당 강하제의 개발이 필요한 실 정이다. 서양금혼초 부위별 추출물의 α-glucosidase 억제활성 을 분석한 결과는 Table 3과 같다.

α-Glucosidase inhibitory activity of 70% ethanol extracts from Hypocahaeris radicata flower, leaf, stem and root.
각 추출물의 IC50 값을 측정한 결과 α-glucosidase 억제활성 은 flower 추출물 (756.33 ± 5.68㎍/㎖)의 경우 실험 농도 범위 내에서 저해 활성을 나타내었으며 대조구인 acarbose (IC50 = 509.39 ± 22.27㎍/㎖)에 비해 조금 낮은 활성을 나타내었다. 강원도 자생식물 추출물들의 α-amylase 및 α-glucosidase 저해 활성 연구에서 민들레속 식물들의 경우에는 α-amylase 및 α- glucosidase 저해활성이 10㎎/㎖에서 20% 이하의 저해 활성 을 가진다고 보고하였으나 (Kim et al., 2011), 같은 민들레속 식물인 서양금혼초의 경우 이보다 높음을 확인하였다.
서양금혼초 부위별 추출물의 생리활성을 비교한 결과, 항산 화 활성을 확인하기 위해 실시한 DPPH radical 소거능, ABTS radical 소거활성 및 환원력 측정에서 flower 추출물이 가장 높은 활성을 보여주었으며, 특히 DPPH radical 소거능에 서는 양성대조군인 BHT보다 높은 활성을 나타내었다. 이러한 결과는 flower 추출물에 높게 함유되어 있는 polyphenol 함량 에 기인한 것으로 판단되어진다. 피부 미백 효과 및 항당뇨 효과를 확인하기 위하여 측정한 tyrosinase 및 glucosidase 저 해 활성 측정 결과 flower 추출물이 실험 농도 범위에서 저해 활성을 나타내었으나 미백소재로 사용되어지는 arbutin 및 항당 뇨 치료제로 사용되어지고 있는 acarbose 보다는 낮은 활성을 나타내었다. 이는 다양한 식물 추출물에 함유되어진 phenolic 성 분 및 flavonoid 성분들은 tyrosinase 및 glucosidase를 비롯한 다양한 효소들을 저해한다는 연구결과와 비슷한 결과를 나타 내었다 (Orhan and Khan, 2014; Vinayagam and Xu, 2015). 이러한 결과를 바탕으로 생태계교란식물인 서양금혼초 를 활용한 천연 기능성 신소재 개발은 활용 가치가 높을 것으 로 생각된다.
감사의 글
본 연구는 2016년도 한국과학창의재단(2016년도 학부생 연 구프로그램 지원사업)의 지원에 의해 이루어진 결과로 이에 감 사드립니다.
REFERENCES
-
Blois, MS, Antioxidant determinations by the use of stable free radical, Nature, (1958), 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Bohlmann, F, Bohlmann, R, Three guaianolides from Hypochoeris radicata, Phytochemistry, (1980), 19, p2045-2046.
[https://doi.org/10.1016/0031-9422(80)83041-x]

-
Chon, SU, Bae, CH, Lee, SC, Antioxidant and cytotoxic potentials of methanol extracts from Taraxacum officinale F. H. Wigg. at different plant parts., Korean Journal of Plant Resources, (2012), 25, p232-239.
[https://doi.org/10.7732/kjpr.2012.25.2.232]

- Finkel, T, Signal transduction by reactive oxygen species, The Journal of Cell Biology, (2011), 194, p7-15.
- Gulua, L, Pruidze, G, Mchedlishvili, N, Omiadze, N, Pruidze, N, A novel catechol reductase catalytic activity of tea leaf phenol oxidase, Journal of Biological Physics and Chemistry, (2002), 2, p89-94.
-
Hanefeld, M, The role of acarbose in the treatment of noninsulin- dependent diabetes mellitus, Journal of Diabetes and itsComplications, (1998), 12, p228-237.
[https://doi.org/10.1016/s1056-8727(97)00123-2]

-
Hyun, TK, Kim, HC, Kim, JS, Antioxidant and antidiabetic activity of Thymus quinquecostatus Celak, Industrial Crops and Products, (2014), 52, p611-616.
[https://doi.org/10.1016/j.indcrop.2013.11.039]

-
Im, DY, Lee, KI, Antioxidative and antibacterial activity and tyrosinase inhibitory activity of the extract and fractions from Tarxacum coreanum Nakai, Korean Journal of Medicinal Crop Science, (2011), 19, p238-245.
[https://doi.org/10.7783/kjmcs.2011.19.4.238]

- Jung, SY, A study on the distribution characteristics of invasive alien plant(IAP) in South Korea, Ph. D. Thesis, (2014), Andong National University, p1-82.
-
Kaur, C, Kapoor, HC, Anti-oxidant activity and total phenolic content of some Asian vegetables, International Journal of Food Science and Technology, (2002), 37, p153-161.
[https://doi.org/10.1046/j.1365-2621.2002.00552.x]

-
Kim, EJ, Choi, JY, Yu, M, Kim, MY, Lee, S, Lee, BH, Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants, Korean Journal of Food Science and Technology, (2012), 44, p337-342.
[https://doi.org/10.9721/kjfst.2012.44.3.337]

-
Kim, HY, Lim, SH, Park, YH, Ham, HJ, Lee, KJ, Park, DS, Kim, KH, Kim, SM, Screening of ?-amylase, ?- glucosidase and lipase inhibitory activity with Gangwon-do wild plants extracts, Journal of Korean Society Food Science and Nutrition, (2011), 40, p308-315.
[https://doi.org/10.3746/jkfn.2011.40.2.308]

-
Kim, JS, Kim, KC, Antioxidant and ?-glucosidase inhibitory activities of Tradescantia pallida(Rose) Hunt leaf extract and fractions, Korean Journal of Medicinal Crop Science, (2016), 24, p222-227.
[https://doi.org/10.7783/kjmcs.2016.24.3.222]

-
Kim, MH, Jeong, EJ, Kim, YS, Studies on the antioxidative activities and active components of the extracts from Pleurotus ostreatus, Journal of Food Hygiene and Safety, (2016), 31, p119-125.
[https://doi.org/10.13103/jfhs.2016.31.2.119]

- Kim, MJ, Kim, SJ, Kim, SS, Lee, NH, Hyun, CG, Hypochoeris radicata attenuates LPS-induced inflammation by suppressing p 38, ERK, and JNK phosphorylation in RAW 264.7 macrophages, Experimental and Clinical Sciences Journal, (2014), 13, p123-136.
- Lee, SJ, Bu, HJ, Lee, JA, Jung, DS, Screening of plants in Jeju for whitening materials in cosmeceutical, Journal of the Society of Cosmetic Scientists of Korea, (2005), 31, p115-119.
-
Maisuthisakul, P, Suttajit, M, Pongsawatmanit, R, Assessment of phenolic content and free radical-scavenging capacity of some Thai indigenous plants, Food Chemistry, (2007), 100, p1409-1418.
[https://doi.org/10.1016/j.foodchem.2005.11.032]

-
Manach, C, Scalbert, A, Morand, C, Remesy, C, Jimenez, L, Polyphenols Food sources and bioavailability, The American Journal of Clinical Nutrition, (2004), 79, p727-747.
[https://doi.org/10.1093/ajcn/79.5.727]

-
Maruta, Y, Fukushi, Y, Ohkawa, K, Nakanishi, Y, Tahara, S, Mizutani, J, Antimicrobial stress compounds from Hypochoeris radicata, Phytochemistry, (1995), 38, p1169-1173.
[https://doi.org/10.1016/0031-9422(94)00792-r]

- Orhan, IE, Khan, MTH, Flavonoid derivatives as potent tyrosinase inhibitors A survey of recent findings between 2008- 2013, Current Topics in Medicinal Chemistry, (2014), 14, p1486-1493.
- Park, SH, A study on naturalized plants introduced into Korea(in Korean), (1994), The Korean Association for Conservation of Nature, Seoul Korea, p39-50.
-
Prota, G, Regulatory mechanisms of melanogenesis Beyond the tyrosinase concept, Journal of Investigative Dermatology, (1993), 100, pS156-S161.
[https://doi.org/10.1038/jid.1993.6]

-
Rahman, I, Biswas, SK, Kirkham, PA, Regulation of inflammation and redox signaling by dietary polyphenols, Biochemical Pharmacology, (2006), 72, p1439-1452.
[https://doi.org/10.1016/j.bcp.2006.07.004]

-
Rice-Evans, CA, Miller, NJ, Paganga, G, Structureantioxidant activity relationships of flavonoids and phenolic acids, Free Radical Biology and Medicine, (1996), 20, p933-956.
[https://doi.org/10.1016/0891-5849(95)02227-9]

- Saudek, CD, Eder, HA, Lipid metabolism in diabetes mellitus, The American Journal of Medicine, (1979), 66, p843-852.
-
Senguttuvan, J, Paulsamy, S, Karthika, K, Phytochemical analysis and evaluation of leaf and root parts of the medicinal herb, Hypochaeris radicata L for in vitro antioxidant activities, Asian Pacific Journal of Tropical Biomedicine, (2014), 4, pS359-S367.
[https://doi.org/10.12980/apjtb.4.2014c1030]

- Singleton, VL, Orthofer, R, Lamuela-Raventos, RM, Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent, Methods in Enzymology, (1999), 299, p152-178.
- Valko, M, Leibfritz, D, Moncol, J, Cronin, MTD, Mazur, M, Telser, J, Free radicals and antioxidants in normalphysiological function and human disease, The International Journal of Biochemistry and Cell Biology, (2007), 39, p44-84.
-
Vinayagam, R, Xu, B, Antidiabetic properties of dietary flavonoids A cellular mechanism review, Nutrition and Metabolism, (2015), 12, p1-20.
[https://doi.org/10.1186/s12986-015-0057-7]

- Yang, YH, Kim, MH, A study on the distribution and vegetation of Hypochoeris radicata community group in Jeju Island, Korean Journal of Plant Resources, (2002), 15, p227-236.
-
Yoon, NY, Eom, TK, Kim, MM, Kim, SK, Inhibitory effect of phlorotannins isolated from Ecklonia cava on mushroom tyrosinase activity and melanin formation in mouse B16F10 melanoma cells, Journal of Agricultural and FoodChemistry, (2009), 57, p4124-4129.
[https://doi.org/10.1021/jf900006f]

-
Zhou, K, Yu, L, Total phenolic contents and antioxidant properties of commonly consumed vegetables grown in Colorado, LWT-Food Science and Technology, (2006), 39, p1155-1162.
[https://doi.org/10.1016/j.lwt.2005.07.015]