GC-MS 기반 대사체학 기술을 응용한 참당귀의 산지비교분석
© The Korean Society of Medical Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
A set of logical criteria that can accurately identify and verify the cultivation region of raw materials is a critical tool for the scientific management of traditional herbal medicine.
Volatile compounds were obtained from 19 and 32 samples of Angelica gigas Nakai cultivated in Korea and China, respectively, by using steam distillation extraction. The metabolites were identified using GC/MS by querying against the NIST reference library. Data binning was performed to normalize the number of variables used in statistical analysis. Multivariate statistical analyses, such as Principal Component Analysis (PCA), Partial Least Squares-Discriminant Analysis (PLS-DA), and Orthogonal Partial Least Squares-Discriminant Analysis (OPLS-DA) were performed using the SIMCA-P software. Significant variables with a Variable Importance in the Projection (VIP) score higher than 1.0 as obtained through OPLS-DA and those that resulted in p-values less than 0.05 through one-way ANOVA were selected to verify the marker compounds. Among the 19 variables extracted, styrene, α-pinene, and β-terpinene were selected as markers to indicate the origin of A. gigas.
The statistical model developed was suitable for determination of the geographical origin of A. gigas. The cultivation regions of six Korean and eight Chinese A. gigas. samples were predicted using the established OPLS-DA model and it was confirmed that 13 of the 14 samples were accurately classified.
Keywords:
Angelica gigas Nakai, Gas Chromatography-Mass Spectrometer, Metabolomics, Multivariate Statistical Analyses, Orthogonal Partial Least Squares-Discriminant Analysis, Principal Component Analysis서 언
한약재의 원산지를 정확히 구별하는 것은 매우 중요하다. 그 이유는 재배지의 환경적 요인이 대사물질의 다양성을 유도하 여 그 치료효과를 나타내는데 결정적 역할을 할 수도 있기 때 문이다 (Lee et al., 2008; Zhang et al., 2010). 최근 안전성 이 확립되지 않은 이엽우피소를 건강기능식품 제조에 사용한 가짜 백수오 사건이 사회적으로 물의를 일으켰다. 또한, 중국 등 외국의 값싼 한약재를 국내산 한약재와 섞는 등 국산으로 둔갑시켜 판매하는 사례가 증가하면서 재배농가의 경작기피와 일반인들의 한약에 대한 불신 뿐 만 아니라 오남용으로 인한 부작용 발생의 위험이 대두되고 있다. 따라서 한의약산업 발 전을 위해서 과학적인 원산지 관리를 목적으로 한약재의 원산 지 감별기법을 개발하는 것은 매우 시급하다.
대사체학 (metabolomics)은 Nuclear Magnetic Resonance (NMR), Gas Chromatography-Mass Spectrometer (GC-MS), Liquid Chromatography-Mass Spectrometer (LC/MS) 등 다 양한 분석기기를 사용하여 생체 내에 존재하는 저분자 대사체 를 광범위하게 분석하고, 다변량 통계 분석 (multivariate data analysis)을 통하여 내인성 대사체의 변화를 연구하는 분야로, 신약 개발 및 평가, 질병의 조기진단 뿐만 아니라 농산물이나 한약재 등의 원산지 판별 등 다양한 분야에서 응용되고 있다 (Arbona et al., 2009; Claudino et al., 2012; De Vos et al., 2007; Fiehn, 2002; Lindon et al., 2007; Yang et al., 2014).
GC/MS 분석은 mass spectra를 NIST library와 비교함으로 써 물질 확인이 가능한 장점이 있으며, 유도체화 과정 없이 간단하게 정유성분을 분석하여 원산지 판별모델에 활용하고 있다 (Fukusaki and Kobayashi, 2005; Kanani et al., 2008; Kende et al., 2010). 대사체학 기법의 하나인 주성분 분석 (Principal Component Analysis, PCA)은 다변량 데이터가 갖 고 있는 정보들을 최대한 확보하면서 서로 독립적이고 적은 수의 새로운 변수들을 생성하고 다차원의 자료를 2차원 또 는 3차원의 주성분 공간으로 추출하는 통계기법이라고 할 수 있다. 직교부분최소자승판별 (Orthogonal Partial Least Squares Discriminant Analysis, OPLS-DA)은 classification을 통해 집 합이라는 종속변수를 부여하여 판별에 기여하는 각 데이터의 시각화를 극대화하고 실험군 간 차이가 있는 대사산물을 찾을 수 있게 도와주는 통계 기법으로서, 예측모델의 확립과 판별에 기여하는 변수 탐색에 가장 적합한 방법이다 (Bylesjo et al., 2006; Hong, 2014; Westerhuis et al., 2010).
중국당귀 [Angelica sinensis (Olive.) Diels]는 한약 (수급조 절대상품목)으로 지정되어 의약품이 아닌 식품으로만 일부 수 입되지만, 식품용 한약재를 의약품으로 전용하는 사례가 있어 중국당귀가 불법으로 유통되는 경우가 발생하고 있다. 또한, 최 근 중국에서는 국내산 참당귀 (Angelica gigas Nakai)의 종자를 중국으로 가져가 재배하여 다시 국내로 역수입되어 들어오는 사례가 있어 산지별 마커 분석 및 판별모델의 확립이 시급하다.
본 연구에서는 국내 및 중국의 각 재배지에서 직접 수집한 참당귀를 수증기 증류하여 얻은 휘발성분을 GC/MS로 분석하 였다. 각 peak의 mass spectrum pattern에 대하여 NIST library에서 일치하는 성분을 규명하였고 gas chromatogram의 peak intensity 분석을 통해 정량분석한 후, 그 결과에 대하여 PCA, OPLS-DA 등 다변량 통계 분석을 수행함으로써 참당귀 의 원산지 판별모델을 확립하였다. 또한, 확립된 OPLS-DA 판 별 모델을 이용하여 14개의 참당귀 시료를 분석하여 산지 예측 을 해본 결과, 13개 시료에서 정분류 됨을 확인할 수 있었다. 본 연구의 결과를 활용하여 한약 동일종의 원산지 판별모델 확립과 과학적인 관리에 적용할 수 있으리라 판단되기에 보고 하고자 한다.
재료 및 방법
1. 시험재료
본 연구에 사용한 재료는 보건복지부 2010년도 식물대사체 연구팀 (주관기관 대전대학교)에서 직접 수집한 참당귀 (Angelica gigas Nakai)로서 중앙대학교 약학대학의 황완균 교 수님과 대전대학교 한의과대학 본초학교실 서영배 교수님께서 각 재배지에서 식물학적 기원을 지상부의 외형과 근경의 현미 경적 관찰로 확인하였고, 재배농가에서 수확하여 건조한 약 재를 직접 수집한 것으로 국내산 참당귀 25 종류와 중국산 참당귀 40 종류이다. 국내산은 경북 봉화군과 영천시, 충북 제천시, 강원 홍천군, 경남 함양군에서 수집하였고, 중국산은 길림성의 연변 (Yanbian), 통화 (Tonghwa), 훈춘 (Hunchun), 그리고 백산 (Baishan), 저장성 단동 (Dandong)과 후순 (Fushun), 감수성 (Gansu), 흑룡강성 (Heilongjiang)에서 수집 하였다 (Table 1). 이들 시료 중 국내산은 19개, 중국산은 32 개의 시료를 분석하여 판별모델의 확립에 사용하였고, 모델의 검증을 목적으로 국내산 6개, 중국산 8개의 시료를 사용하여 산지예측을 하였다. 진균 (fungi) 오염이 확인된 시료를 제외 하고 산지별 건조시료 10 g을 취해 세절 후 분쇄하였다.
2. 정유의 추출 및 GC/MS 분석시료의 조제
각각의 시료로부터 정유를 추출하기 위해, 유럽 약전 (EDQM, 2015)에 기재되어 있는 Clevenger-type apparatus를 이용한 수증기증류 방법을 사용했다 (Clevenger, 1928; Özek et al., 2010). 간략히 기술하면, 10 g의 시료에 250㎖의 증류 수를 넣고 80℃에서 6시간 동안 수증기증류 하였다. 증류물이 포집된 에테르 (J.T. Baker, Philipsburg, NJ, USA) 분획에 무수 황산나트륨 (Junsei, Tokyo, Japan)을 넣어 탈수한 후, 건조시켜 헥산 (J.T. Baker, Philipsburg, NJ, USA)으로 용해 하여 GC/MS 분석시료로 사용하였다.
3. 분석기기 및 조건
Kim 등 (2006)의 방법을 기초로, 정유성분 분석을 위하여 Bruker 320-MS GC quadrupole mass spectrometer (Bruker, Billerica, MA, USA)를 사용하였으며 컬럼은 HP-5MS (30 m × 0.25㎜, film thickness 250㎛, Agilent, Santa Clara, CA, USA)를 사용하였다. 운반기체로 순도 99.999% 헬륨가 스를 유속 1.0㎖/min로 사용하였다. 주입구 온도는 250℃로 정하였고 분할 주입 (1 : 1) 방법을 사용하였으며, 컬럼온도는 50℃에서 4분간 유지시킨 후 5℃/min로 280℃까지 올리고 10분간 유지하였다. 이온검출 방법은 스캔모드를 사용하여 EI (Electron Impact Ionization, 70.0 eV) 법으로 m/z값 50 - 500 범위를 조사하였다. 분석과정 상의 오차를 줄이기 위해, 시험시료의 분석 순서는 산지나 번호순으로 하지 않고 임의의 순서를 정하여 분석하였다.
4. 데이터 분석
GC-MS 분석을 통해 얻은 피크는 NIST08 mass spectral library의 데이터 베이스를 이용하여 동정하였다 (NIST, 2008). 통계학적 분석을 위해 각 시료의 Total Ion Chromatography (TIC)로부터 나온 GC-MS (time vs intensity) 데이터를 ASCII file로 변환하여 엑셀 파일 (*.csv)로 저장하였다. 각 시료들 사 이에 존재하는 실험오차를 보정하고 통계분석에 사용되는 변수 의 수를 줄이기 위해 GC-MS 데이터의 변수를 0.2min 간격으 로 더하는 데이터 binning을 수행하였다. 예를 들면 4.00min에 서 4.19min까지의 intensity를 더하여 새로운 변수 (variable)인 4.1을 만들었고, 이러한 방법으로 60분까지 총 285개의 새로운 변수를 만들어 통계분석에 사용하였다.
5. 다변량 통계분석
SIMCA-P, ver 11.0 software (Umetrics, Umea, Sweden)를 이용해 chemometric method인 PCA, PLS-DA (Partial Least Squares-Discriminant Analysis), OPLS-DA 분석을 수행하였다.
6. 원산지 판별 마커 대사체 탐색법
Lee 등 (2013)의 방법을 기초로 OPLS-DA 분석을 통해 VIP (Variable Importance in the Projection)를 얻어 유의성 있는 변수를 추출하였다. VIP는 두 집단이 나뉘었을 경우 변 수들마다 기여한 정도의 차이를 나타내며, 두 그룹을 구분하 는데 가장 기여한 정도가 큰 변수들을 찾아내기 위해 사용되 었다. 보통 VIP score가 1.0 이상인 변수들에 대하여 유의성 이 있다고 보기 때문에 여러 가지 변수 중 VIP score가 1.0 이상인 변수들을 선택하였다. 더욱 정확한 결과를 위해 표준 편차는 1.0 미만인 것을 선택하였다. 그리고 통계프로그램인 SPSS 11.0 (SPSS Inc., Chicago, IL, USA)을 사용하여 oneway ANOVA (analysis of variance)를 통하여 p-value가 0.05 미만인 변수를 추출하였다.
결과 및 고찰
1. 대사체의 분석 및 동정
Fig. 1의 (A)는 국내산 참당귀시료의 대표적인 total ion chromatogram이며, (B)는 중국산 참당귀시료의 대표적인 TIC 를 나타낸 것이다. 화살표 및 숫자로 표기한 피크는 NIST mass spectra library를 이용하여 동정한 피크를 표시한 것이다. GC/MS 분석으로 얻은 TIC 및 MS fragment 양상을 기초로 NIST mass spectra library부터 대사체의 정성분석이 용이했다. 한편, 중국산과 국내산 참당귀 시료의 피크 intensity와 양상이 다른 것을 육안으로 확인할 수 있었다.
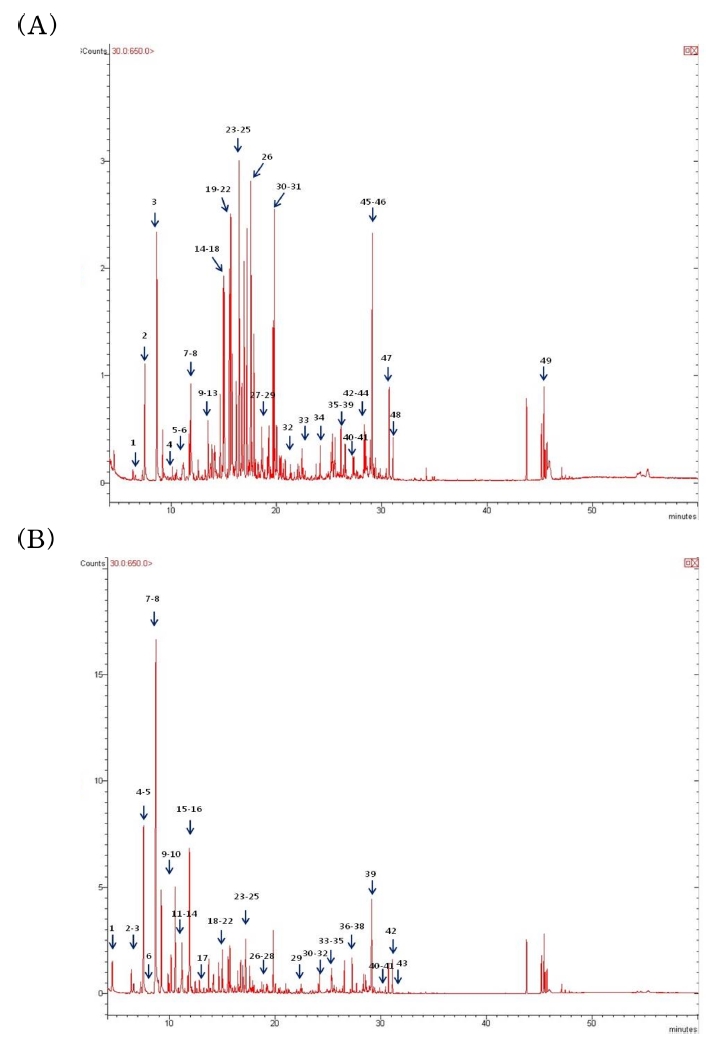
Total ion chromatograms of volatile constituents of extract of A. gigas cultivated in Korea (A) and extract of A. gigas cultivated in China (B) obtained by GC/MS EI scan mode.
Table 2와 Table 3에는 각각 국내산과 중국산 참당귀의 GC/MS 분석으로부터 예상되는 대사체를 NIST mass spectra library로부터 동정한 결과를 나타내었다. 1-Benzyl-1,2,3-triazole, 2,6-dimethyl-1,3,6-heptatriene, β-farnesene, 4-terpinenol, α- terpinolene, bicycloelemene, bicyclogermacrene, E,E-α-farnesene, β-myrcene, β-phellandrene, δ-3-carene, β-terpinene, dl-limonene, ethyl linolenolate, guaiol, hexanal, myrtanol, 2-methyloctane, styrene 등을 포함하여 국내산은 45개, 중국산은 43개의 피크가 동정되었다. 국내산 참당귀에서만 동정된 대사체는 bicyclo[3.1.1] hept-3-en-2-one,4,6,6-trimethyl-,[1S-(1α,2β,5α)], muskolactone, myrtenol, cubenol, trans-carveol 등을 비롯하여 22개 화합물 이며, 중국산 참당귀에서는 β-phellandrene, β-terpinene, E,E- α-farnesene, guaiol, myrtanol 등 23개 화합물, 그리고 두 시 료 모두에서 동정된 대사체는 camphene, p-cymen-7-ol, α- muurolene, nonane, α-pinene, γ-terpinene 등 23개 화합물이다. 한편, 국내산 참당귀의 18번과 20번 피크는 p-mentha-1,5-dien-8- ol, 21번과 22번 피크는 p-cymen-7-ol, 29번과 31번 피크는 cisthujan- 10-oic acid methyl ester로 각각 근접한 RT에서 검출되었 으며 동일한 화합물로 동정되었다 (Table 2, 3). Silane, dimethyldecyloxyhexadecyloxy-는 분석과정에서 오염된 물질로 추정된다. 한편, Kim 등 (2006)은 참당귀 휘발성 성분인 α- pinene, limonene, β-eudesmol, elemol 등을 보고하였으며 이는 본 논문의 대사체 동정 결과와 대부분 일치하였다. 또한, 참당 귀의 주성분으로는 decursin, decursinol 등의 coumarin 유도체 등이 보고되었다 (Kim et al., 2006).

The list of identified metabolites from extract of A. gigas cultivated in Korea. NIST library-based putative identification of primary metabolites analyzed by GC/MS.
2. 다변량 통계분석을 통한 판별
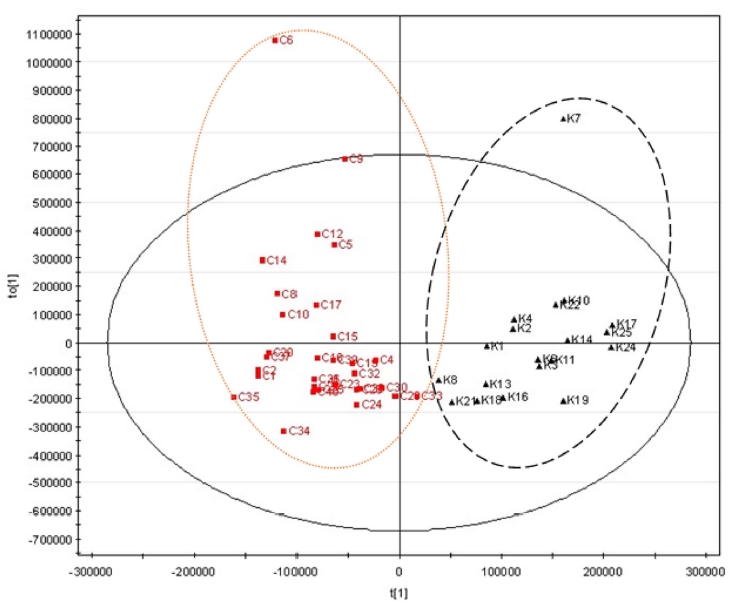
PCA, PLS-DA, OPLS-DA 등의 다변량 통계분석법을 시도 해 본 결과, PCA 는 각각 9개의 국내산 참당귀와 7개의 중 국산 참당귀가 중첩되어 모델 확립에는 적합하지 않았다 (data not shown). PLS-DA에서도 PCA에서 보다는 약간 개선되었 지만, 각각 7개의 국내산 참당귀와 3개의 중국산 참당귀가 중 첩되어 역시 모델 확립에는 적합하지 않았다 (data not shown). Fig. 2에 나타난 바와 같이, OPLS-DA에서는 국내산 참당귀와 중국산 참당귀의 모든 시료가 중첩되지 않고 잘 분 리되었으며, 따라서 OPLS-DA를 이용하여 참당귀의 산지 판 별 모델을 확립하였다. 한편, PCA는 독립변수만을 이용하여 새로운 주성분을 구하고 그 주성분을 이용하여 회귀식을 구하 는 반면, PLS는 독립변수뿐만 아니라 종속변수를 동시에 고 려하여 새로운 변수를 찾고 이를 이용하여 회귀식을 구하므로 PCA보다는 PLS에서 더욱 개선된 결과를 얻을 수 있다. OPLS-DA는 분광학적 데이터와 데이터의 특정 성질, 예를 들 면 어떤 그룹에 속하는지의 여부를 연관시키는 회기 분석법 중의 하나로, 이 방법은 주 관심의 대상인 그룹간의 차이가 첫 번째 특이 벡터에 나타나도록 데이터 행렬을 회전시킴으로 써 관찰값과 서로 다른 그룹간의 연관된 변이를 쉽게 알아낼 수 있다 (Bylesjo et al., 2006; Wiklund et al., 2008). 한편, Tianniam 등 (2008)은 일당귀 (Angelica acutiloba)의 당, 유 기산과 아미노산 등을 GC-TOF MS로 분석하고 PCA를 통한 산지판별모델을 보고하였다. 즉, 일본의 4개 산지로부터 구입 한 일당귀의 1, 2차 대사물질의 분포양상에 따라 PCA score 의 값에 차이가 확인되었으며 판별의 유의성을 제시하였다.
3. 원산지 판별 마커 대사체
국내산 참당귀와 중국산 참당귀를 판별할 수 있는 마커 대 사체를 검출하기 위해 OPLS-DA 분석으로부터 얻어진 VIP score가 1.0 이상으로 유의성이 있는 변수 (variable)를 선발하 고 더욱 정확한 결과를 위해 그 중에 표준오차가 1.0 미만인 것을 추출하였다 (Fig. 3). VIP plot은 두 그룹을 나뉘게 하는데 기여를 한 순서에 따라 분류된다. 그리고 one-way ANOVA를 통하여 p-value가 0.05 미만인 변수들을 추출한 결과, 변수 4.1 (4.00min - 4.19min), 4.9 (4.80min - 4.99min), 9.1 (9.00min - 9.19min), 13.5 (13.40 min - 13.59 min) 변수 등 유의성 있는 변수 19개가 선택되었다. Table 4에 나타낸 바와 같이, VIP와 SPSS를 통해 동시에 추출된 유의성 있는 변수들 중 GC/MS NIST library 탐색을 통해 동정된 성분은 styrene (7.19 min), α-pinene (8.95 min), β-terpinene (9.86 min)으로 총 3 가지 의 마커 대사체를 얻을 수 있었다 (Table 4). 한편, Kim 등 (2011)은 국내산 참당귀를 시료로 1H NMR과 UPLC-MS를 활용하여 1차 및 2차 대사체를 분석하였다.
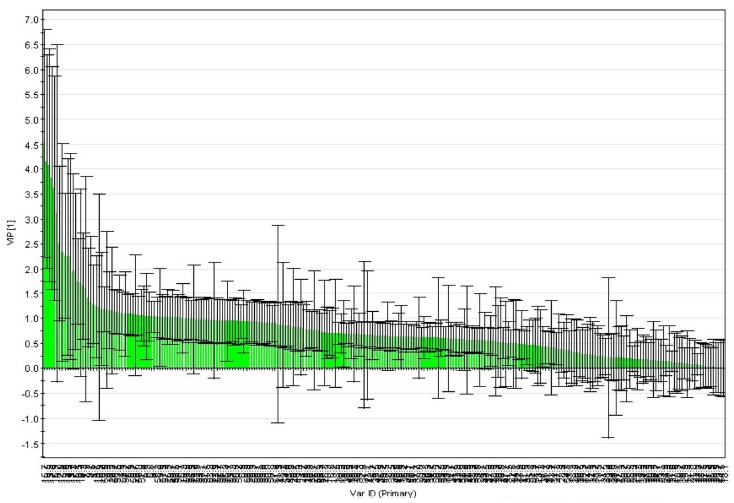
Plot of variable importance in the projection from the OPLS-DA of volatile metabolites that identified by GC/ MS of A. gigas.OPLS-DA; Orthogonal Partial Least Squares Discriminant Analysis.
4. 미지시료의 검증
이상과 같이 확립된 국내산 참당귀와 중국산 참당귀의 OPLS-DA 판별모델의 정확도를 검증하고자 미지시료의 분석 값을 적용하였다. 이미 산지를 알고 있는 시료인 국내산 6개 와 중국산 8개를 미지시료로 정하여 수증기 증류로 얻은 휘발 성 분획을 GC/MS로 분석하였다. 이 때 분석 순서는 무작위 로 정하여 수행함으로써 주관적 예측과 판별은 지양하였다. 그 결과, Fig. 4에서 보는 바와 같이 총 14개의 시료 중 중국산 1개 시료를 제외하고 13개의 시료가 정분류 되었으며 정확도 는 93%이었다.
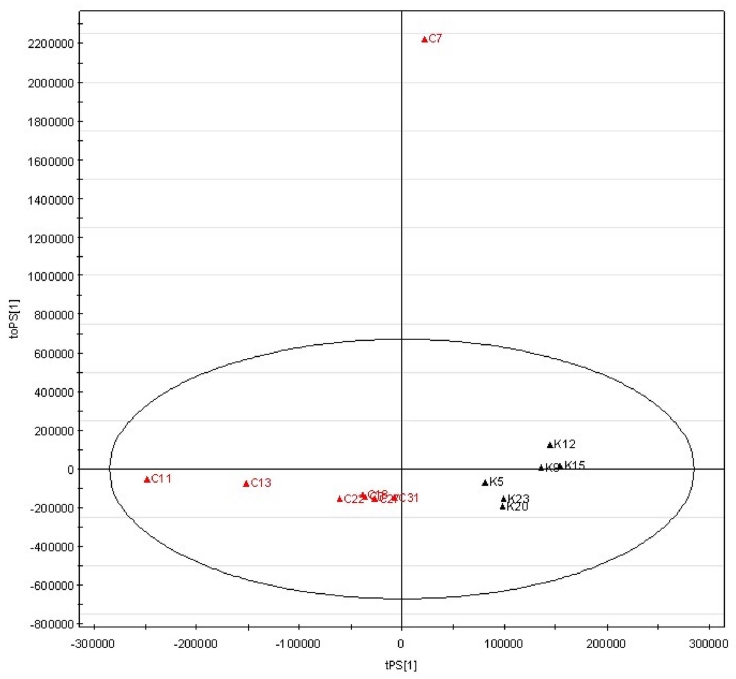
Predicted score scatter plot of blind samples of A. gigas on OPLS-DA model.A. gigas samples from Korea are represented with a ▲K, samples from China with a ▲ C, samples. OPLS-DA; Orthogonal Partial Least Squares Discriminant Analysis.
이상의 결과를 종합해 보면, GC/MS 분석을 기반으로 대사 체학 기법을 사용하여 한약의 원산지 판별모델을 확립함으로 써 국내산 참당귀와 중국산 참당귀의 과학적인 관리에 적용할 수 있을 것이며, 나아가 다른 한약의 원산지 판별모델을 확립 하는데도 기여할 것으로 사료된다. 한편, 본 연구에서는 수확 후 건조한 당해연도의 시료를 사용하였기 때문에 연차에 따른 변수를 고려하지 않았으나, 한약재의 대사체는 연차 및 건조 조건과 건조 후 저장조건에 따라 변할 수 있으므로 이점을 고 려하여 분석시료를 수집해야할 것이다. 또한 이러한 대사체학 연구에 의해 한약의 과학적 관리가 용이해짐으로써 한약발전 에도 크게 기여할 것을 확신한다.
감사의 글
본 연구는 2011년도 보건복지부의 연구용역사업과 우석대학 교 교내 연구비로 수행된 것으로 이에 감사드립니다. 도움을 주신 경희대 장영표 교수, 최호영 교수, 서울대 성상현 교수, 중앙대 황완균 교수, 대전대 서영배 교수께 감사드립니다.
REFERENCES
-
Arbona, V, Iglesias, DJ, Talon, M, Gomez-Cadenas, A, Plant phenotype demarcation using nontargeted LC-MS and GC-MS metabolite profiling, Journal of Agricultural and Food Chemistry, (2009), 57, p7338-7347.
[https://doi.org/10.1021/jf9009137]

- Bylesjo, M, Rantalainen, M, Cloarec, O, Nicholson, JK, Holmes, E, Trygg, J, OPLS discriminant analysis Combining the strengths of PLS-DA and SIMCA classification, Journal of Chemometrics, (2006), 20, p341-351.
-
Claudino, WM, Goncalves, PH, di Leo, A, Philip, PA, Sarkar, FH, Metabolomics in cancer A bench-to-bedside intersection, Critical Reviews in Oncology/Hematology, (2012), 84, p1-7.
[https://doi.org/10.1016/j.critrevonc.2012.02.009]

-
Clevenger, JF, Apparatus for the determination of volatile oil, Journal of American Pharmaceutical Association, (1928), 17, p345-349.
[https://doi.org/10.1002/jps.3080170407]

-
De Vos, RCH, Moco, S, Lommen, A, Keurentjes, JJB, Bino, RJ, Hall, RD, Untargeted large-scale plant metabolomics using liquid chromatography coupled to mass spectrometry, Nature Protocols, (2007), 2, p778-791.
[https://doi.org/10.1038/nprot.2007.95]

- rizwan, m, European Directorate for the Quality of Medicines and Healthcare(EDQM) European pharmacopoeia technical guide for the elaboration of minographs European Directorate for the Quality of Medicines and Healthcare, Strasbourg France. https://www.edqm.eu/sites/default/files/technical_guide_for_the_elaboration_of_monographs_7th_edition_20151.pdf (cited by 2015 April 20), (2015).
- Fiehn, O, Metabolomics The link between genotypes and phenotypes, Plant Molecular Biology, (2002), 48, p155-171.
-
Fukusaki, E, Kobayashi, A, Plant metabolomics Potential for practical operation, Journal of Bioscience and Bioengineering, (2005), 100, p347-354.
[https://doi.org/10.1263/jbb.100.347]

- Hong, YS, Nutritional metabolomics, Journal of the Korean Society of Food Science and Nutrition, (2014), 43, p179-186.
- Kanani, H, Chrysanthopoulos, PK, Klapa, MI, Standardizing GC-MS metabolomics, Journal of Chromatog, (aphy), B.; 2008, 871, p191-201.
- Kende, A, Portwood, D, Senior, A, Earll, M, Bolygo, E, Seymour, M, Target list building for volatile metabolite profiling of fruit, Journal of Chromatog, (aphy), A.; 2010, 1217, p6718-6723.
-
Kim, EJ, Kwon, J, Park, SH, Park, C, Seo, YB, Shin, HK, Kim, HK, Lee, KS, Choi, SY, Ryu, DH, Hwang, GS, Metabolite profiling of Angelica gigas from different geographical origins using 1H NMR and UPLC-MS analyses, Journal of Agricultural and Food Chemistry, (2011), 59, p8806-8815.
[https://doi.org/10.1021/jf2016286]

- Kim, MR, Abd El-Aty, AM, Kim, IS, Shim, JH, Determination of volatile flavor components in danggui cultivars by solvent free injection and hydrodistillation followed by gas chromatographic-mass spectrometric analysis, Journal of Chromatog, (aphy), A.; 2006, 1116, p259-264.
-
Lee, DK, Yoon, MH, Kang, YP, Yu, J, Park, JH, Lee, J, Kwon, SW, Comparison of primary and secondary metabolites for suitability to discriminate the origins of Schisandra chinensis by GC/MS and LC/MS, Food Chemistry, (2013), 141, p3931-3937.
[https://doi.org/10.1016/j.foodchem.2013.06.064]

- Lee, HW, Choi, JH, Park, SY, Choo, BK, Chun, JM, Lee, AY, Kim, HK, Constituents comparison of components in native and cultivated species of Angelica tenuissima Nakai, Korean Journal of Medicinal Crop Science, (2008), 16, p168-172.
- Lindon, JC, Holmes, E, Nicholson, JK, Metabolomics in pharmaceutical R&D, Federation of European Biochemical Societies Journal, (2007), 274, p1140-1151.
- rizwan, m, National Institute of Standards and Technology(NIST) NIST08 mass spectral library(NIST08/2008), National Institute of Standard and Technology. Gaithersburg. MD. USA. http: //nist.gov/srd/nist1a.cfm (cited by 2011 Nov 20), (2008).
- Özek, G, Demirci, F, Özek, T, Tabanca, N, Wedge, DE, Khan, SI, Baser, KHC, Duran, A, Hamzaoglu, E, Gas chromatographic-mass spectrometric analysis of volatiles obtained by four different techniques from Salvia rosifolia Sm, And evaluation for biological activity. Journal of Chromatography A, (2010), 1217, p741-748.
-
Tianniam, S, Tarachiwin, L, Bamba, T, Kobayashi, A, Fukusaki, E, Metabolic profiling of Angelica acutiloba roots utilizing gas chromatography-time-of-flight-mass spectrometry for quality assessment based on cultivation area and cultivar via multivariate pattern recognition, Journal of Bioscience and Bioengineering, (2008), 105, p655-659.
[https://doi.org/10.1263/jbb.105.655]

- Westerhuis, JA, van Velzen, EJJ, Hoefsloot, HCJ, Smilde, AK, Multivariate paired data analysis Multilevel PLSDA versus OPLSDA, Metabolomics, (010), p119-128.
-
Wiklund, S, Johansson, E, Sjstrm, L, Mellerowicz, EJ, Edlund, U, Shockcor, JP, Gottfries, J, Moritz, T, Trygg, J, Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models, Analytical Chemistry, (2008), 80, p115-122.
[https://doi.org/10.1021/ac0713510]

-
Yang, SO, Lee, SW, Kim, YO, Lee, SW, Kim, NH, Choi, HK, Jung, JY, Lee, DH, Shin, YS, Comparative analysis of metabolites in roots of Panax ginseng obtained from different sowing methods, Korean Journal of Medicinal Crop Science, (2014), 22, p17-22.
[https://doi.org/10.7783/kjmcs.2014.22.1.17]

-
Zhang, A, Sun, H, Wang, Z, Sun, W, Wang, P, Wang, X, Metabolomics Towards understanding traditional Chinese medicine, Planta Medica, (2010), 76, p2026-2035.
[https://doi.org/10.1055/s-0030-1250542]