인삼열매추출물의 용매분획물이 LPS로 유도된 RAW264.7 세포에 대한 항염활성
© The Korean Society of Medicinal Crop Science. All rights reserved
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Anti-inflammatory activity of the extracts of ginseng berry (GBE) was investigated through the evaluation of its inhibitory effect on the production of inflammatory meditator, nitric oxide(NO), tumor necrocis factor-alpha (TNF-α), interleukin-6 (IL-6) in LPS-induced RAW264.7 macrophage cells. GBE was fractionated using n-hexane, chloroform, ethylacetate, buthanol and H2O, sequentially. RAW264.7 cells were induced 100 ng/mℓ of lipopolysaccharide (LPS) and treated with 0, 1.6, 8, 40 and 200 μg/mℓ of GBE fractions. LPS-induced NO production on all of GBE fractions was inhibited with increasing added concentration of GBE fractions. Chloroform fraction of GBE was the most effective in inhibiting LPSinduced TNF-α production. Hexane, chloroform and H2O fractions of GBE exhibit strong inhibition LPS-induced IL-6 production. Especially, H2O fractions of GBE was the most effective in inhibiting LPD-induced IL-6 production without significant cytotoxicity in RAW264.7 cells, and reduced the activation of mitogen-activated protein kinases (MAPK) and IkB phosphorylation. These results indicate that H2O fractions of GBE exhibits strong anti-inflammatory effects by inhibition of NF-kB by inhibition of p-38 on MAPK and IkB phosphorylation.
Keywords:
Ginseng Berry, Solvent Fractions, Anti-Inflammation, Nitric Oxide, Cytokines서 언
최근 한국에서 기능성 건강식품으로 인정받고 있는 인삼 (Panax ginseng C. A. Meyer)은 사포닌이 여러 종류가 함유 되어있으며 각 사포닌 종류마다 기능성을 달리하고 있어 인삼 이 인체에 미치는 각종 질병을 예방하는 차원에서 소비자들이 인삼을 애호해오고 있다. 또한 인삼은 주로 식용하고 있는 부 위가 뿌리로서 뿌리에 함유되어 있는 사포닌이 열에 의하여 기존 수삼에 함유되어있는 10여종 이상의 사포닌 구조의 배당 체 부분이 분해되어 새로운 사포닌 구조가 생김으로서 또 다 른 기능성을 띄는 여러 종류의 사포닌이 생성되는 것이 인삼 사포닌의 주된 특성이다 (Nam, 1996). 이와 같이 열에 의하 여 각종 사포닌 구조물질의 변형이 유도된 주된 인삼제품으로 홍삼 및 흑삼 (구증구포) 제품을 들 수 있다. 그러나 최근 인 삼의 주된 식용부위인 뿌리보다 인삼 잎이나 열매 등 인삼 지 상부에서 뿌리보다 더 많은 사포닌이 함유되어 있어서 이에 대한 연구가 많이 이루어지고 있는 실정이다 (Choi et al., 2009; Kim et al., 2013a, 2014a). 최근 인삼 열매는 인삼종 자를 채취하기 위하여 수확하는 단계에서만 이용되어오던 것 이 인삼열매 내에 각종 사포닌이 더 많이 함유되어있고 그 이 외에 폴리페놀성 물질이나 안토시아닌 색소 등의 여러 기능성 물질이 많이 함유되어 있어서 인삼뿌리보다 더 기능성이 우수 하다는 보고들이 이루어지고 있다 (Xie et al., 2005). 특히 Attele 등 (2002)은 인삼열매에 사포닌 중 진세노사이드 Re성 분이 다량 함유되어 있어 인삼열매 추출물이 항당뇨효과가 우 수함을 입증하였으며, Yeom 등 (2010)은 인삼열매 내 진세노 사이드 Re가 hyaluronic acid의 생성을 촉진하여 피부노화를 억제하였다고 보고하였고, Kim 등 (2010)은 고지방식이를 섭 취한 동물모델을 이용하여 인삼열매추출물을 섭취시킨 결과 혈행개선과 함께 피부톤이 개선하였다고 보고하였다. 또한 Jeon 등 (2011)과 Kim 등 (2013b)은 인삼열매를 유산균 발효 시킨 결과 항산화 및 항노화 작용이 증가되었다고 보고하기도 하였다. 이에 따라 인삼열매를 이용한 각종 제품개발관련으로 인삼열매 추출물을 유효성분으로 함유하는 항염증용 화장료 조성물 (Park et al., 2014) 등의 화장품 소재로 인삼열매를 이용한 특허들이 있으며, 또한 진세노사이드 Re를 강화시킨 인삼열매 추출물 제조 (Pyo et al., 2013), 인삼열매 추출물을 함유하는 아토피 피부염 개선을 위한 식품조성물 제조 (Jo et al., 2014) 등 식품이용에 대한 특허가 나오고 있는 등 인삼열 매에 대한 각종 보고들이 많이 나오고 있다. 이와 같이 인삼 열매는 진세노사이드 Re 등의 사포닌 함량이 높고 각종 유효 성분들이 많아서 이를 이용하고자 하는 관심도가 높아지고 있 는 실정이다. 따라서 본 연구는 인삼열매 중 사포닌 이외의 물질도 많이 함유하고 있으므로 인삼열매 추출물을 용매 분획 별로 성분을 분획한 후 항염활성을 비교하여 인삼열매의 주된 항염활성 물질을 찾는데 기초자료로 제공하고자 하였다.
재료 및 방법
1. 실험재료
본 실험에 사용한 인삼 열매는 충남 금산 지역에서 재배된 4년생 인삼에서 수확하여 세척한 후 인삼 종자파쇄기로 파쇄 할 때 5배수의 물을 가하여 파쇄하면서 과육을 분리 회수하였 다. 분리된 과육 파쇄액을 동결건조하여 실험 전까지 −20℃에 서 냉동 보관하였다.
2. 시료 추출 및 순차 용매 분획
인삼열매 추출물의 용매 분획물을 추출 회수하기 위하여 Choi 등 (2011)의 방법을 일부 변형하여 실시하였다. 즉, 분말 시료 일정량 (100 g)에 70% 메탄올을 20배 중량으로 가하여 30℃에서 24시간 추출한 후 원심분리하여 상등액을 1차적으로 회수하고 다시 침전물을 재 추출하여 원심분리하여 상등액을 회수하여 1차 상등액과 혼합한 후 감압농축기 (Ultra compact evaporator, Rocket, Genevac, Ipswich, England)로 농축하여 메탄올 용매를 증발 제거시킨 물층을 극성이 다른 용매 즉, hexane, chloroform, ethylacetate 및 butanol를 단계적으로 첨 가하여 순차적으로 각각의 용매 분획물을 얻었다. 얻어진 용 매 분획물은 감압농축한 후 동결 건조하여 용매를 제거한 후 실험에 사용하였다.
3. 세포배양
실험에 사용된 마우스 대식세포주인 RAW 264.7 세포는 한 국세포주은행 (Seoul, Korea)에서 분양받아 사용하였으며, 세 포는 5% CO2, 37℃ incubator (SANYO Electric Co. Ltd., Osaka, Japan)에서 배양하였으며 10% fetal bovine serum (FBS)과 1% antibiotics (peniciilin-streptomycin)를 첨가한 DMEM배지를 이용하였다. 배지는 2 ~ 3일마다 교환하였으 며 세포가 80%이상 자랐을 때 phosphate buffered saline (PBS)으로 세척한 후 cell scraper를 사용하여 계대배양 하였 다.
4. 세포독성 측정
인삼열매의 용매 분획물의 농도에 따른 RAW 264.7 세포의 생존율을 측정하기 위하여 cell viability assay를 실시하였다. 100㎕ (5 × 104 cells/well) 의 세포 부유액을 96 well plate에 분주한 후 15시간 배양하였다. 인삼열매 추출물은 DMSO (chloroform, ethylacetate 및 hexane 추출물) 혹은 3차 증류수 (buthanol 및 물층)에 20㎎/㎖이 되도록 준비하였다. 각 인삼 열매 추출물은 0, 1.6, 8, 40 및 200㎍/㎖의 농도가 되도록 세포배양배지로 희석하여 세포에 첨가하고 12시간 전처리하 였다. 그 후 LPS (Sigma, St. Louis, MO, USA)를 최종농도 100 ng/㎖이 되도록 세포에 첨가하여 24시간 동안 염증반응을 유도하였다. 배양 후 MTT용액 (Sigma, St. Louis, MO, USA)을 well 당 10㎕씩 첨가하고 2시간 동안 CO2 배양기 안에서 반응시킨 후 microplate reader를 사용하여 490㎚ 파 장에서 흡광도를 측정하였다. 생존율은 대조군에 대한 흡광 도의 차를 백분율로 표시 비교분석하였다 (Bredt et al., 1994).
5. Nitric Oxide (NO) 측정
LPS 자극에 의해 RAW 264.7세포에서 유도된 염증반응에 대한 각 인삼열매 용매 분획물의 항염증 효과를 측정하기 위 한 일환으로, 세포 배양액 중의 NO를 정량하여 비교하였다. NO의 농도는 배양액 내의 nitrite 농도를 Guzik 등 (2003)의 방법에 따라 측정하였다. RAW 264.7 세포를 48 well plate 에 well당 1 × 105세포가 되도록 분주한 후, 세포증식 실험과 동일한 방법으로 각 인삼열매 분획물을 여러 농도로 12시간 전처리하고, LPS를 처리하여 24시간 배양시켰다. 배양 종료 후 세포배양액을 회수하여 Intron사 (iNtRON Biotechnology, Seongnam, Korea)의 detection kit를 이용하여 NO assay를 정량하였다.
6. Cytokine 측정
NO 측정과 같은 방법으로 세포를 배양한 후, 각 well에서 세포 배양액을 회수하였다. 세포배양 상청액 내의 TNF-α와 IL-6 농도는 enzyme linked immunosorbent assay (ELISA) kit (R&D system, MN, USA)를 이용하여 정량하였다.
7. LPS자극 RAW 264.7 세포에서 물추출 분획물의 세포내 MAPK 및 NF-kB 억제활성
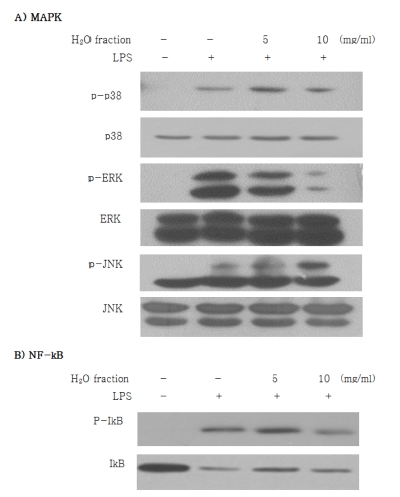
세포독성이 낮고 염증매개인자 생성 억제활성이 높았던 H2O 분획물층에 대한 세포내 MAPK (mitogen-activated protein kinases) 억제활성을 측정하기 위하여 인삼열매 물분획물층을 0, 5 및 10㎍/㎖의 농도로 세포를 12시간 전처리하고, 그 후 LPS (100 ng/㎖)를 처리한 후 15분간 배양하였다. 배양이 종 료 후, 세포를 2 ~ 3회 PBS (Phosphate buffered saline)로 세 척하고, RIPA (radioimmune precipitation assay) buffer로 세 포를 30분 ~ 1시간 동안 lysis시키고 BCA법에 의해 단백질을 정량하였다. 각 그룹당 10㎍의 단백질을 SDS-PAGE용 12% gel의 각 lane에 넣고 전기영동한 후, PVDF membrane에 단 백질을 transfer하였다. MAPK (mitogen-activated protein kinases)와 I-kB의 인산화는 Western blot (Eum et al., 2013) 에 의해 측정하였다. IκB, p38, ERK, JNK, phosphorylated p38 (p-p38) phosphorylated ERK (p-ERK), phosphorylated JNK (p-JNK)에 대한 항체 (R&D Systems, MN, USA)를 각 membrane에 실온에서 반응시키고, 각 항체에 대한 2차 항체 (horseradish peroxidase-conjugated antibodies, R&D Systems, Minneapolis, MN, USA)를 첨가하여 실온에서 반응시켰다. 반 응이 끝난 후 ECL kit을 이용하여 각 band를 발현시켜 관찰 하였다.
8. 통계처리
본 연구의 실험결과들은 각 처리구 시료에 대하여 3회 반복 측정하여 이루어졌으며 모두 평균 ± 표준편차값으로 나타내 었다. 모든 자료의 통계분석은 SAS (Statistical Analysis System) software package (SAS 9.1.3, SAS Institute Inc., Cary, NC, USA)를 이용하여 일원분산분석 (one-way ANOVA) 를 통해 그 값을 구하였으며 평균값의 차이는 p < 0.05의 조건 에서 유의성을 인정하였다.
결과 및 고찰
1. 인삼 열매 추출물 및 용매 분획물의 세포 증식에 미치는 영향
대식세포는 생체 내 모든 조직에 골고루 분포되어 있으며 선천성 면역을 담당하는 면역세포이다. 대식세포는 병원체 등 으로 인한 염증반응 시에 NO와 같은 활성산소종 및 IL-6과 같은 염증성 사이토카인을 생산하여 감염초기에 생체 방어에 중요한 역할을 하는 세포로 알려져 있다 (Higuchi et al., 1990; Willeaume et al., 1996). 본 연구에서는 인삼열매 추출 물의 용매 분획물 중 어느 분획물층에서 항염증 활성이 가장 높은지를 검토하기 위하여 마우스의 대식세포주인 RAW264.7 세포를 통하여 in vitro 실험을 진행하기 전 세포증식에 미치 는 영향을 관찰한 결과 Fig. 1과 같았다. 인삼열매 추출물의 용매 분획물에 대한 세포생존율을 본 결과 hexane분획물과 ethylacetate분획물층은 200㎍/㎖의 농도에서부터 세포생존율 이 낮아져서 100㎍/㎖ 이상의 농도에서는 세포생존율을 거의 볼 수 없을 정도로 강한 독성을 보였으며 chloroform분획물층 도 20㎍/㎖의 농도에서는 안전적이었으나 100㎍/㎖ 이상의 농도에서는 세포생존율을 상당히 낮음을 보였다. 그러나 buthanol과 H2O분획물층은 고농도에서도 세포독성이 거의 없 이 안전적임을 볼 수 있었다.
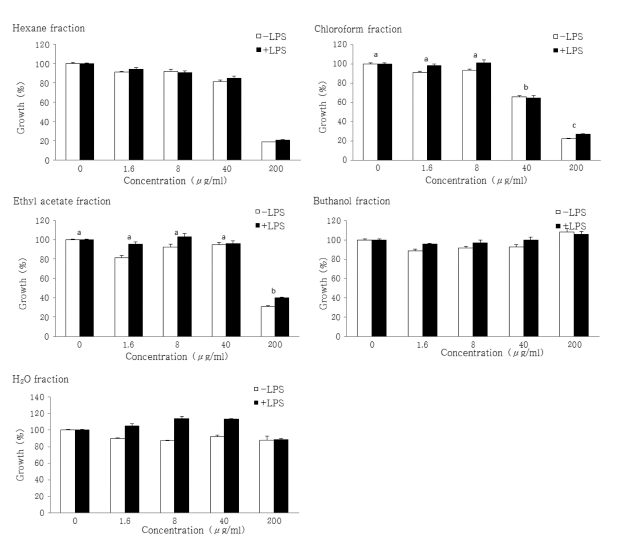
Effect of sequential solvent fractions of ginseng berry on the viability of RAW 264.7 macrophage cells.The cells were induced with 100 ng/mL of LPS or with LPS plus various concentrations (0, 1.6, 8, 40 and 200㎍/㎖) of solvent fraction of GBE for 24 hours. Data were expressed as the mean ± SD from three independent experiments. Mean with difference letter (a-d) within a column are significant differences at p < 0.05 by one-way ANOVA. □-LPS; LPS untreated, ■-LPS; LPS treated.
2. Nitric Oxide (NO) 생성 저해 효과
NO는 외부상처에 대한 반응 및 염증 같은 면역방어기전의 다양한 과정을 매개하는 cytokines인 interleukin 1 (IL-1)이나 tumor necrosis factor (TNF) 등에 유도된 inducible nitric oxide synthase (i-NOS)에 의하여 생성된다. 이 NO는 병리적 인 혈관확장, 세포독성, 조직손상 등과 같은 생체에 유해한 작 용을 나타내며 (Park and Yang, 2008), 특히 염증상태에서 생 성된 NO는 혈관투과성 및 부종 등의 염증반응을 촉진시키는 것으로 알려져 있다 (Aeberhard et al., 1995). 이와 같이 활 성산소 중의 하나이며, 최근 염증 유발에 중요한 역할을 하는 것으로 알려진 NO생성에 대한 인삼열매 용매분획물층별의 효 과를 측정한 결과 Fig. 2와 같았다. 대부분의 분획물에서 억제 작용을 나타내었으며 chloroform분획물과 NO생성 억제효과가 높은 분획물층인 ethylacetate분획물층은 40㎍/㎖ 농도처리까 지는 농도 의존적으로 억제효과가 높았으나 200㎍/㎖ 이상의 농도에서는 오히려 감소하는 결과를 보여주었고, hexane, buthanol 과 H2O분획물층은 농도 의존적으로 NO생성 억제활 성이 증가함을 볼 수 있었다. 일반적으로 식물성 재료의 용매 분획물에 대한 항염증 활성 중 NO 생성억제 효과가 높은 분 획은 ethylacetate분획물로 보고되어진 바가 많다 (Choi et al., 2011; Park and Yang, 2008; Lee et al., 2012; Byun, 2012). 일반적으로 ethylacetate분획물에서 검출되어지는 폴리 페놀성 물질이나 플라보노이드 물질이 대부분 많아서 이러한 물질이 항산화 및 항염증 활성에 관여한다고 하지만 (Cha et al., 1999; Lu and Foo, 2000; Tsao, 2010), Kwon 등 (2009)은 홍고추가루에서 수용성 추출물이 항염증 효과가 컸 다고 보고하였으며 Park와 Yang (2008)은 황촉규 추출물에서 NO생성 억제가 분획물 중 dichloromethane분획물에서 가장 컸고 이어서 ethylacetate분획물에서도 생성억제 효과가 있었다 고 보고한 것도 있다. 또한 Yang 등 (2012)은 산벚나무잎 추 출물 및 분획물에서 항염증 효과를 본 결과 ethylacetate와 buthanol분획물층에서 항산화효과와 함께 NO소거활성능이 높 았지만 hexane과 chloroform분획물층에서 NO생성억제 활성이 컸다고 보고하였고, Kim 등 (2014b)은 밤나무의 부위별에 따 른 항염증 활성을 비교한 결과 밤나무 잎에서 NO억제활성이 높았다고 보고한 결과 등을 보면 주로 지상부에 있는 폴리페 놀성 물질이 항염활성을 가지는 것으로 생각된다.
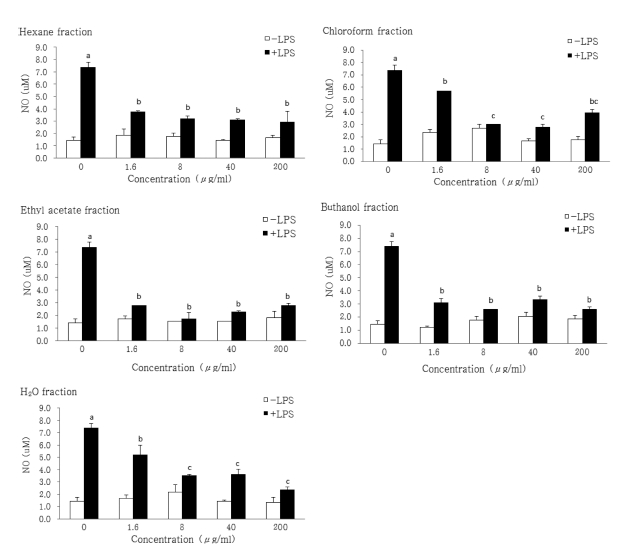
Inhibitory effects on NO production in LPS-induced RAW 264.7 macrophage cells by the sequential solvent fractions of ginseng berry.The cells were induced with 100 ng/mL of LPS or with LPS plus various concentrations (0, 1.6, 8, 40 and 200㎍/㎖) of solvent fraction of GBE for 24 hours. Data were expressed as the mean ± SD from three independent experiments. Mean with difference letter (a-d) within a column are significant differences at p < 0.05 by one-way ANOVA. □-LPS; LPS untreated, ■-LPS; LPS treated.
본 인삼열매도 ethylacetate분획물이 NO생성 억제효과가 가 장 높게 나온 것을 볼 수 있어서 인삼열매에 많이 함유되어 있는 사포닌 보다는 폴리페놀성물질 쪽의 성분이 항염 활성에 주된 원인 물질일 것으로 생각된다.
3. 염증성 cytokine 분비에 미치는 영향
RAW264.7 세포에서 LPS에 의해 유도된 대표적인 염증성 cytokine인 TNF-α와 IL-6 (Tizard, 1986) 의 생성량에 미치는 인삼열매 용매분획물의 영향을 조사하였다. Fig. 3에서 보는 바와 같이 TNF-α의 경우는 인삼열매 용매분획물층 모두 약한 억제활성을 보였으며 그 중 chloroform분획물층은 농도 의존 적으로 억제활성이 높아지는 것을 볼 수 있었으며 Fig. 4와 같이 IL-6의 경우는 모든 용매분획물층이 높은 억제활성을 보 였으며 특히 세포독성이 낮은 H2O분획물층에서 매우 높은 활 성을 보였다. Kim 등 (2012)은 chlologenic acid 등의 폴리페 놀성 물질이 다량 함유된 두충잎 추출물이 LPS로 유도된 RAW264.7 cells에서 TNF-α와 IL-6의 발현을 억제하였다고 보고한 바 있다. 따라서 NO생성 억제에 따른 cytokines의 발 현을 억제하는 것으로 볼 수 있었다.
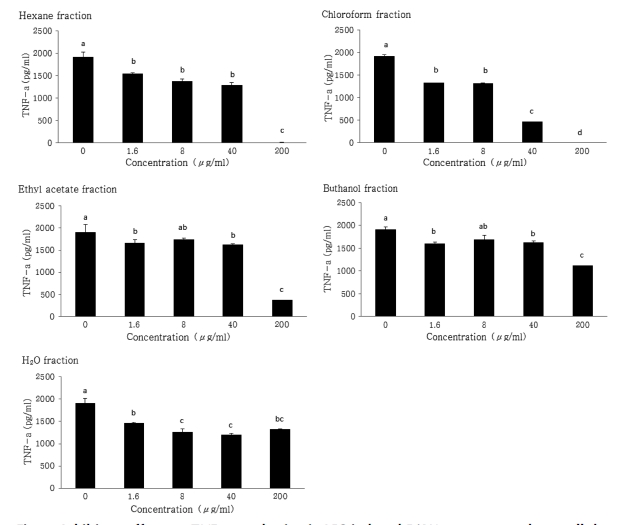
Inhibitory effects on TNF-α production in LPS-induced RAW 264.7 macrophage cells by the sequential solvent fractions of ginseng berry.The cells were induced with 100 ng/㎖ of LPS plus various concentrations (0, 1.6, 8, 40 and 200 ㎍/㎖) of solvent fraction of GBE for 24 hours. Data were expressed as the mean ± SD from three independent experiments. Mean with difference letter (a-d) within a column are significant differences at p < 0.05 by one-way ANOVA.
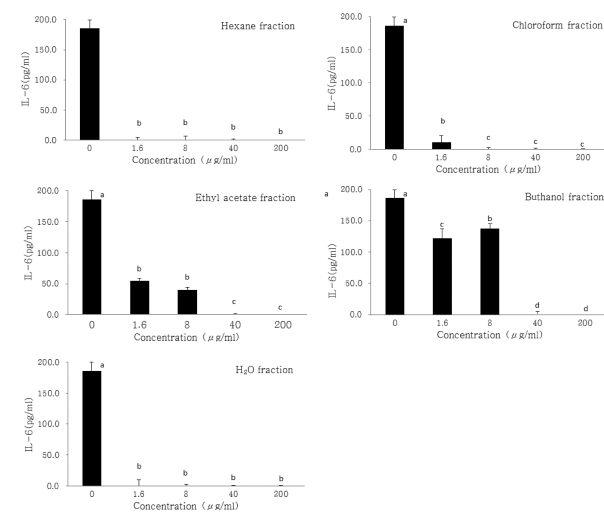
Inhibitory effects on IL-6 production in LPS-induced RAW 264.7 macrophage cells by the sequential solvent fractions of ginseng berry.The cells were induced with 100㎍/㎖ of LPS plus various concentrations (0, 1.6, 8, 40 and 200㎍/㎖) of solvent fraction of GBE for 24 hours. Data were expressed as the mean ± SD from three independent experiments. Mean with difference letter (a-d) within a column are significant differences at p < 0.05 by one-way ANOVA.
4. 인삼열매 물분획물층이 세포 내 신호전달에 미치는 영향
일반적으로 염증반응은 MAPK의 활성을 유도하며 MAPK 는 signal-regulated protein kinase (ERK), c-Jun terminal kinase (jnk), 그리고 p38이 있다 (Ho et al., 2007; Song et al., 2008). 인삼열매 용매분획물 중 가장 독성이 낮고 염증매 개인자 생성 억제활성이 가장 높았던 H2O분획물층에 대하여 MAPK 및 NF-kB signaling을 통하여 염증관련 인자들을 조 절하는지를 확인하기 위하여 Western blot를 수행하였다. 그 결과 Fig. 5에서 보는 바와 같이 인삼열매 H2O분획물층의 첨 가량이 높아질수록 p-p38, p-ERK 및 p-JNK이 감소하는 것을 확인할 수 있었다. 또한 NF-kB는 IkB와 결합하여 비활성화된 상태로 존재하는데 염증반응이 일어나게 되면 IkB가 phosphorylation되어 떨어져나가면서 NF-kB를 활성화가 이루 어지게 된다 (Hawiger 2001; Nam, 2006). 본 실험결과 인삼 열매 H2O분획물층이 IkB의 인산화가 감소되어진 것으로 보아 인삼열매 H2O추출분획물층의 항염증활성에 기여하는 것은IkB 의 인산화 억제를 통한 NF-kB의 활성화를 억제함으로서 항염 증 작용을 발휘하는 것으로 생각된다. 본 연구결과 인삼열매 의 세포독성이 가장 낮은 분획물은 buthanol과 H2O분획물층 이었으며 NO생성억제 활성은 ethylacetate분획물층이었고, TNF-α 생성억제 활성은 chloroform분획물층으로 나타났으며 IL-6생성억제 활성은 hexane, chloroform 및 H2O분획물층으로 나타났다. 따라서 세포독성이 가장 낮은 H2O분획물층에 의한 세포 내 MAPK활성을 측정한 결과 인삼열매 추출물의 H2O 분획물층이 세포내 p38 및 ERK의 인산화를 억제시킴으로서 NF-kB의 활성이 억제되어 항염증 작용을 발휘하는 것으로 확 인되었다. Jung 등 (2014)이 보고한 뚝새풀 에탄올추출물에서 LPS로 유도된 RAW264.7 cells에서 세포내 NF-kB억제 단백질 인 Ik-Bα의 활성을 측정한 결과 인산화 반응을 억제하여 NO 와 TNF-α의 분비억제 반응기작에 NF-kB의 translocation이 억 제되어 pro-inflammatory cytokine인 TNF-α와 IL-6의 발현을 억제한다고 보고한 것과 거의 유사한 기작에 의한 항염활성을 가지는 것으로 생각된다. 따라서 인삼열매 추출물에서 차후 IkB의 인산화를 억제시키는 주된 물질의 동정이 필요할 것으 로 생각된다.
감사의 글
본 연구는 농촌진흥청 지역특화작목기술개발사업「인삼부 산물의 기능성 향상을 위한 전처리기술(과제번호: PJ009 45901)」지원에 의해 수행된 것으로 이에 감사드립니다.
REFERENCES
- Aelberhard, EE, Henderson, SA, Arabolos, NS, Griscavage, JM, Castro, FE, Barrett, CT, Ignarro, LJ, Nonsteroidal anti-inflammatory drugs inhibit expression of the inducible nitric oxide synthase gene, Biochemical and Biophysical Research Communications, (1995), 208, p1053-1059.
-
Attele, AS, Zhou, YP, Xie, JT, Wu, JA, Zhang, L, Dey, L, Pugh, W, Rue, PA, Polonsky, KS, Yuan, CS, Antidiabetic effects ofPanax ginsengberry extract and the identification of an effective component, Diabetes, (2002), 51, p1851-1858.
[https://doi.org/10.2337/diabetes.51.6.1851]

-
Bredt, DS, Snyder, SH, Nitric oxide A Physiologic messenger molecule, Annual Review of Biochemistry, (1994), 63, p175-195.
[https://doi.org/10.1146/annurev.biochem.63.1.175]

- Byun, MY, Anti-inflammatory activity of austroinulin fromStevia rebaudianain LPS-induced RAW2647 cells, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p456-461.
- Cha, JY, Kim, HJ, Chung, CH, Cho, YS, Antioxidative activities and contents of polyphenolic compound of Cudrania tricuspidata, Journal of the Korean Society of Food Science and Nutrition, (1999), 28, p1310-1315.
- Choi, JE, Li, X, Han, YH, Lee, KT, Changes of saponin contents of leaves, stems and flower-buds ofPanax ginsengC. A. Meyer by harvesting days, Korean Journal of Medicinal Crop Science, (2009), 17, p251-256.
-
Choi, SJ, Cho, EA, Cho, EH, Jeong, YJ, Ku, CS, Ha, BJ, Chae, HJ, Screening of functional materials from solvent fractions of apple flower leaf extract, Journal of KoreanSociety for Biotechnology and Bioengineering, (2011), 26, p165-171.
[https://doi.org/10.7841/ksbbj.2011.26.2.165]

- Guzik, TJ, Korbut, R, Adamek-Guzik, T, Nitric oxide and superoxide in inflammation and immune regulation, Journal of Physiological Phamacology, (2003), 54, p469-487.
-
Hawiger, J, Innate immunity and inflammation A transcriptional paradigim, Immunological Research, (2001), 23, p99-109.
[https://doi.org/10.1385/ir:23:2-3:099]

- Higuchi, M, Hisgahi, N, Taki, H, Osawa, T, Cytolytic mechanisms of activated macrophages. tumor necrosis factor and L-arginine-dependent mechanisms act synergistically as the major cytolytic mechanisms of activated macrophages, Journal of Immunology, (1990), 144, p1425-1431.
- Jeon, JM, Choi, SK, Kim, YJ, Jang, SJ, Cheon, JW, Lee, HS, Antioxidant and antiaging effect of ginseng berry extract fermented by lactic acid bacteria, Journal of the Society of Cosmetic Scientists of Korea, (2011), 37, p75-81.
- Jo, NH, Park, CY, Lee, SJ, Health food for improving atopic dermatitis and xerosis containing ginseng fruit extracts, Korea. Patent. 10-1382115, (2014).
- Jung, HK, Kang, BM, Jang, JH, Ahn, BK, Yeo, JH, Jung, WS, Cho, JH, Kuk, YI, Hyun, KH, Cho, HW, Inhibitory effect ofAlopecurus aequalisSobol ethanol extracts on LPSinduced inflammatory response in RAW2647 cells, Korean Journal of Medicinal Crop Science, (2014), 22, p98-104.
- Kim, HJ, Yoo, KM, Lee, S, Kim, KT, Hwang, IK, Physicochemical characteristics of various ginseng seeds, Korean Journal of Food Science Technology, (2013a), 45, p274-278.
- Kim, JE, Lee, S, Yoo, KM, Lee, KH, Kim, KT, Lee, MH, Hwang, IK, Quality characteristics of ginseng seed oil obtained by different extraction methods, Journal of the Korean Society of Food Science and Nutrition, (2014a), 43, p439-445.
- Kim, JK, Kim, BS, Park, CW, Seo, DB, Yoo, HR, Lee, SJ, Effect of ginseng-berry extract on the improvement of blood microcirculation and skin brightness, Korean Journal of Oriental Physiology and Pathology, (2010), 24, p85-90.
- Kim, JY, Kim, SY, Kwon, HM, Kim, CH, Lee, SJ, Park, SC, Kim, KH, Comparision of antioxidant and anti-inflammatory activity on chestnut, chestnut shell and leaves of Castanea crenata extracts, Korean Journal of Medicinal Crop Science, (2014b), 22, p8-16.
-
Kim, YO, Lee, SW, Sohn, SH, Kim, SY, Oh, MS, Kim, SK, Anti-inflammatory effects of water extract of Eucommia ulmoides oliver on the LPS-induced RAW2647 cells, Korean Journal of Medicinal Crop Science, (2012), 20, p381-386.
[https://doi.org/10.7783/kjmcs.2012.20.5.381]

- Kim, ST, Kim, HJ, Jang, SK, Lee, DI, Joo, SS, Establishment of optimal fermentation conditions for steamdried ginseng berry via friendly bacteria and its antioxidant activity, Korean Journal of Food Science Technology, (2013b), 45, p77-83.
-
Kwon, HS, Shin, HK, Kwon, SO, Yeo, KM, Kim, SM, Kim, BN, Kim, JK, Antiinflammatory effects of aqueous extract from red pepper on lipopolysaccharide induced inflammatory responses in murine macrophages, Journal of the Korean Society of Food Science and Nutrition, (2009), 38, p1289-1294.
[https://doi.org/10.3746/jkfn.2009.38.10.1289]

-
Lee, HN, Kim, JK, Kwon, GT, Shim, JH, Kim, JD, Yoon, JH, Anti-inflammatory effects of ethanol extract from bark of Acer barbinerve Maxim, Journal of the Korean Society of Food Science and Nutrition, (2012), 41, p1242-1247.
[https://doi.org/10.3746/jkfn.2012.41.9.1242]

-
Lu, Y, Foo, LY, Antioxidant and radical scavenging activities of polyphenols from apple pomace, Food Chemistry, (2000), 68, p81-85.
[https://doi.org/10.1016/s0308-8146(99)00167-3]

-
Nam, NH, Naturally occurring NF-kB inhibitors, Mini Reviews in Medicinal Chemistry, (2006), 6, p945-951.
[https://doi.org/10.2174/138955706777934937]

- Nam, KY, The new Korean ginseng(constituent and its pharmacological efficacy), (1996), Daejeon, Korea, Korea Ginseng & Tabacco Research Institute, p1-10.
- Park, CW, Yeom, MH, Cosmetic composition for antiinflammation containing ginseng fruit extracts, Korea. Patent. 10-1427574, (2014).
- Park, EY, Yang, KS, In hibition of nitric oxide production by the extracts ofHibiscus manihot, Yakhak Hoeji, (2008), 52, p259-263.
- Pyo, MK, Lee, KH, Seol, SH, Yoo, JH, Hong, SC, Kim, BR, Lee, HJ, Park, JD, Preparation for the extract of ginseng berry containing increased ginsenoside Re, Korea. Patent. 10-1330935, (2013).
- Seong, IH, Beverage contained de-alcohol activity substance comprising extract of ginseng fruit, ginseng flower stalks, raisin tree fruit and manufacturing method thereof, Korea. Patent. 10-1125130, (2012).
-
Tsao, R, Chemistry and biochemistry of dietary polyphenols, Nutrients, (2010), 2, p1231-1246.
[https://doi.org/10.3390/nu2121231]

- Tizard, IR, Immunology an introduction inflammation, (1986), 2nd ed, New York. NY, USA, Saunder College Publishing, p423-441.
- Willeaume, V, Kruys, V, Mijatovic, T, Huez, G, Tumor necrosis factor-alpha production induced by viruses and by lipopolysaccharide in macrophage Similarities and differences, Journal of Inflammatory, (1996), 46, p1-12.
- Xie, JT, Mehendale, S, Yuan, CS, Ginseng and diabetes, The Americn Journal of Chiense Medicine, (2005), 33, p397-404.
-
Yang, SA, Pyo, BS, Kim, SM, Lee, KI, Antibacterial activity and nitric oxide production inhibitory activity of the extract and its fractions from the leaves ofPrunus sargentii, Korean Journal of Medicinal Crop Science, (2012), 20, p308-314.
[https://doi.org/10.7783/kjmcs.2012.20.4.308]

- Yeom, MH, Lee, JY, Kim, JS, Park, CW, Kim, DH, Kim, HK, The anti-aging effects of korean ginseng berry in the skin, Korean Journal of Pharmacognosy, (2010), 41, p26-30.