증숙 발효 공정에 의한 파삼의 진세노사이드 전환 수율 증진
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study was performed to enhance contents of low molecular ginsenoside using steaming and fermentation process in low quality fresh ginseng. For increase in contents of Rg2, Rg3, Rh2 and CK in low quality fresh ginseng, a steaming process was applied at 90°C for 12 hr which was followed by fermentation process at Lactobacillus rhamnosus HK-9 incubated at 36°C for 72 h. The contents of ginsenoside Rg1, Rb1, Rc, Re and Rd were decreased with the steaming associated with fermentation process but ginsenoside Rg2, Rg3, Rh2 and CK increased after process. It was found that under the steaming associated with fermentation process, low molecule ginsenosides such as Rg2, Rg3, Rh2 and CK were increased as 3.231 mg/g, 2.585 mg/g and 1.955 m/g and 2.478 mg/g, respectively. In addition, concentration of benzo[α]pyrene in extracts of the low quality fresh ginseng treated by the complex process was 0.11 ppm but it was 0.22 ppm when it was treated with the steaming process. This result could be caused by that the most efficiently breakdown of 1,2-glucoside and 1,4-glucoside linkage to backbone of ginsenosides by steaming associated with fermentation process. This results indicate that steaming process and fermenration process can increase in contents of Rg2, Rg3, Rh2 and CK in low quality fresh ginseng.
Keywords:
Low Quality Fresh Ginseng, Steaming Process, Fermentation Process, Ginsenoside Conversion Pattern서 언
과거부터 한의약뿐만 아니라 민간요법으로 널리 알려져 사 용되어온 대표적인 약용식물인 고려인삼 (Panax ginseng C. A. Meyer)은 오갈피나무과 (Araliaceae)의 인삼 속에 속하는 다년생 초본류 로서 과거부터 한방 의약에 사용되어온 우리나 라의 대표 특산물이다 (Lee et al., 2011). 인삼의 뿌리에는 전분 등의 탄수화물이 약 60 ~ 70%의 높은 함량을 가지고 있 으며, 그 이외에 triterpenoid saponins을 비롯한 polyacetylenes, phenolic compounds, peptidoglycans등의 성분을 함유하고 있 다 (Lee et al., 2011). 특히, 인삼에서 얻어지는 주요 생리활 성 물질인 진세노사이드를 중심으로 많은 연구가 이루어지고 있으며 대개 인삼의 생리활성 연구는 사포닌 계의 진세노사이 드를 중심으로 많은 연구가 이루어져 있는데, 주로 면역 및 항산화 효과, 중추신경계, 기억력, 학습효능개선 및 항 스트레 스 등에 관한 활성들에 관해 많은 연구가 진행되고 있으며, 전이 억제 작용, 항 당뇨 작용, 간 기능개선, 방사선 방법 작 용 등의 다양한 약리 작용이 연구되고 있다 (Li, 1992; Singh et al., 1984; Benishin, 1992).
이러한 인삼으로부터 얻어지는 고부가가치 산물인 진세노사 이드는 다양한 방법을 통해서 얻을 수 있다. 인삼의 추출 방 법으로는 기본적인 열수 추출 및 에탄올 추출과 발효를 통해 진세노사이드를 전환하는 방법과 초고압, 초음파, 압출 성형방 법 등을 이용한 물리적인 추출 방법을 통해 진세노사이드를 고농도로 얻기 위한 연구가 이루어졌다 (Jeong et al., 2009; Jeong et al., 2005; Yu et al., 2005). 하지만 진세노사이드 중 저분자 진세노사이드 (단당류로 이루어지는 R 그룹에 −H 수소 잔기가 있는 진세노사이드) Rg2, Rg3, Rh2, CK 등은 고분자 진세노사이드 (단당류로 이루어지는 R 그룹에 −H 수 소 잔기가 없는 진세노사이드) Rg1, Rb1, Rb2, Rc, Rd 등에 존재하는 glucose, arabinose 내지는 rhamnose의 가수분해를 통해 보다 작은 진세노사이드가 되는데 이러한 당의 결합은 β-1,2-glycoside 또는 β-1,4-glycoside 등으로 존재하는데 당의 가수분해를 하기위해서는 다량의 에너지가 투입이 되거나 특 정 효소를 통해서 가수분해 하여 고분자 진세노사이드를 저분 자 진세노사이드로 전환시켜야 한다 (Zhou et al., 2008; Zhang et al., 2001). 기존의 인삼을 홍삼이나 흑삼을 만드는 알려진 방법 중 증숙 공정의 경우 고온의 조건으로 인삼 내부 에 존재하는 당기의 가수분해를 유도 한다 (Doh et al., 2007; Park et al., 2006).
기존의 사용되어진 증숙 공정은 1회 증숙을 하는 홍삼 제조 와 9번 증숙하는 흑삼 제조로 나뉘는데 1회 증숙시 얻어지는 저분자 진세노사이드 Rg3의 함량은 약 0.42mg/g으로 매우 적 은양이 함유되어 지고 있고, 총 4회 이상부터 함량이 크게 증 진되어 총 9회 증숙 까지 약 6.41mg/g에서 9.22mg/g으로 증 진된다고 보고되었다 (Jo et al., 2011; Kim and Kang, 2009). 하지만 상기의 증숙 과정을 여러 번 반복하기 위해 보 통 1주일 이상의 시간이 필요하고 높은 온도를 장시간 유지하 여야 하기 때문에 에너지의 과소비가 존재하며, 얻어진 저분 자 진세노사이드의 함량이 낮은 문제점이 존재 한다 (Yang et al., 2006; Kim and Kang, 2009). 따라서 증숙 공정의 문제 점을 해결하기 위해서는 증숙 공정의 횟수를 줄여서 경제성을 높임과 동시에 저분자 진세노사이드의 함량을 증진 시킬 수 있는 공정의 개발이 필요한 실정이다.
따라서 상기의 증숙 공정의 문제점을 해결하기 위해서 고온 고압의 물리적인 공정을 이용하지 않아도 저분자 진세노사이 드의 함량의 증진이 용이한 발효 공정을 도입 하였다. 발효 공정은 유산균에서 얻어지는 β-glucosidase 효소의 생성으로 인해 진세노사이드에 존재하는 당의 β-1,2 및 β-1,4 결합을 가수분해 시키는 공정으로 기존에 연구가 되어 진 공정이다 (Zhang et al., 2001; Choi et al., 2012). 하지만 기존의 발 효 공정은 발효를 하는 시간이 길고 발효를 통해서도 고농도 의 진세노사이드의 생산이 어려운 단점이 존재 한다 (Zhang et al., 2001; Choi et al., 2012).
따라서 기존에 9번의 구증구포 방법을 사용하지 않고도 최 소한의 증숙 단계를 거칠 수 있으며, 발효를 보다 효과적으로 할 수 있도록 유도하여 공정상의 문제점을 해결하고 증숙과 발효는 다른 공정과는 다르게 scale-up이 용이하기 때문에 추가 적인 개발 비용 없이도 바로 적용이 가능하다는 장점이 있다. 또한, 2가지 공정을 복합적으로 사용하여 시너지 효과를 확인 함과 동시에 각각의 공정 처리 보다 효과적으로 저분자 진세 노사이드를 생산하여 기존의 전처리 방법보다 경제적으로 저 분자 진세노사이드를 증진시키는 방법을 개발하고자 한다.
재료 및 방법
1. 실험 재료
본 실험에서 사용된 파삼은 4년근 파삼으로 2011년 10월에 금산에서 생산된 것으로 충남 금산 농협을 통해 구입하여 사 용하였다. 구입된 4년근 파삼은 분쇄기를 통해 2 ~ 3㎜의 크 기로 분쇄한 후 발효에 사용하였으며, 중숙 공정에 사용된 파 삼은 분쇄 처리를 하지 않은 파삼을 사용하였다. 파삼을 발 효하기 유해 사용된 유산균주는 glucoside 결합을 분해하는 특징을 가지고 있는 Lactobacillus rhamnosus HK-9 (KACC 11254P, Korea) 균주를 이용하였다. 발효에 사용되는 균주의 보관은 배양된 균주와 15% glycerol를 혼합하여 −70°C에서 장기 보관 하였으며, seed culture를 위해 균주를 MRS 배지 (Difco, Marylabnd, USA)에 접종하여 36°C의 조건에서 24시 간동안 배양한 후 사용하였다.
2. 증숙, 발효 및 복합 공정
증숙 공정은 건조된 파삼을 마하스팀기 (Daechang Stainless, Seoul, Korea)에 넣고, 90°C의 조건으로 12시간 증 숙 시킨 후, 12시간 자연 순환 건조시키는 공정을 1회로 설정 하여 총 5회 반복하였다. 증숙 공정을 통해 얻어진 증숙 파삼 을 100°C에서 24시간동안 열수 추출하고, 열수 추출액과 남은 건체 파삼을 분리하였다. 분리된 건체 파삼을 80°C에서 24시 간동안 70% 에탄올로 추출한 후, 열수 추출액과 70% 에탄올 합쳐서 최종 추출액을 얻었다. 파삼의 발효는 1 L flask에서 실험 하였으며, 건조된 파삼을 배지 투입양의 20%를 넣어 발 효를 하였다. 발효 종균으로 MRS 배지에서 24시간 동안 미 리 배양된 Lactobacillus rhamnosus HK-9 균주 (1.0 × 106 CFU/ml)를 사용하였으며, 배양된 배지의 부피대비 10% 만큼 의 종균을 접종하였다. 접종이 완료된 flask를 shaking incubator에 넣은 후 혐기의 조건에서 36°C의 온도로 72시간 동안 배양을 하였다. 상기의 증숙 공정과 같은 방법으로 얻어 진 발효액과 남은 파삼 고형물을 분리한 후 파삼 고형물은 각 각 열수 추출과 70% 에탄올 추출 후 발효액과 섞어 최종 추 출액을 얻어내어 발효액과 파삼 고형물 추출액 혼합물의 사포 닌을 분석 하였다.
복합 공정은 파삼을 마하스팀기 (Daechang Stainless, Seoul, Korea)에 넣고, 90°C의 조건으로 12시간 증숙 시킨 후, 12시간 자연 순환 건조시키는 공정을 1회로 설정하여 총 5회 반복시켜 증숙 파삼을 얻는다. 얻어진 증숙 파삼을 MRS 배지 투입양의 20%를 넣고 Lactobacillus rhamnosus HK-9 균주를 사용하여 혐기의 조건에서 36°C의 온도로 72시간 동안 배양 을 하였다. 증숙, 발효 및 복합 공정 처리된 파삼의 추출액의 여과를 위해 Whatman 사의 20 ~ 25µm 여과지를 사용하여 여 과를 하였으며, 여과 시 감압 여과하여 추출액을 여과하였다. 얻 어진 여과된 추출액은 감압 농축기 (Rotary vaccum evaporator N-N series, EYELA, Japan)를 이용하여 감압 농축하여 24시간 −70°C에서 동결 시킨 후, 동결건조를 시켜 최종 추출액 분말 을 얻는다.
3. 진세노사이드 분석
증숙 및 발효 공정별로 처리된 추출액의 진세노사이드 함량 을 측정하기 위해 부탄올 추출법을 사용하였다. 수포화 부탄 올 50ml에 증숙 및 발효 공정별로 처리된 추출액 파우더 2 g 을 첨가한 후에 증류수 50ml을 추가로 첨가하여 40°C의 온 도에서 10분간 교반 시킨 후에 분획깔대기를 이용하여 수포화 부탄올 층과 증류수 층으로 나누었다. 수포화 부탄올 층은 따 로 분리하였으며, 증류수 층에 다시 수포화 부탄올 50ml을 첨가하여 상기의 과정을 추가로 3회 더 반복하였으며, 총 4번 의 수포화부탄올 층을 얻어내었다. 얻어진 200ml의 수포화 부탄올을 감압 농축하여 조사포닌을 분리하였다. 얻어진 조사 포닌에 4ml의 메탄올을 가하여 용해시키고, 0.45µm 필터로 여과한 다음 HPLC 조건에 따라 진세노사이드의 함량을 측정 하였다 (Choi et al., 2012). 시료의 진세노사이드 분석을 위 해 standard로 Rb1, Rb2, Rc, Rd, Rh2, CK, Rg1, Rg2 및 Rg3 (ChromaDex, Irvine, CA, USA) 를 선정하여 500 ppm 의 농도로 분석하였다. HPLC 기기는 BIO-TEK instrument (Italy)사 HPLC 500 series의 BIO-TEK 522 controller Pump와 BIO-TEK HPLC 535 UV Detector (203㎚)를 사용 하였고, Column은 Alltech사 (Catnip Hill Rd, Nicholasville, KY, USA)의 Prevail C18 (5µm, 4.6 × 150㎜)을 사용하였으며, injection volume은 20µl로 측정하였다. 이동상은 용액 A (Water) 와 B (Acetonitrile)를 사용하였으며, 이동상의 구배는 시간에 따라 (0 ~ 10 min, 80% A와 20% B; 10 ~ 42 min, 80% A와 20% B; 42 ~ 67 min, 70% A와 30% B; 67 ~ 97 min, 60% A와 40% B; 97 ~ 107 min, 50% A와 50% B; 107 ~ 120 min, 10% A와 90% B; 120 ~ 121 min, 80% A 와 20% B; 121 ~ 130 min, 80% A와 20% B)로 설정하였 으며, 유속은 1ml/min으로 흘려주어 진세노사이드의 함량을 분석하였다 (YI et al., 2010; Choi et al., 2012).
4. 벤조피렌 함량 분석
벤조피렌 함량을 측정하기 위해 표준검량곡선을 작성 하여 각각의 시료에 함유된 벤조피렌의 농도를 측정하였다. 벤조피 렌의 표준물질의 농도를 1, 2, 5, 10, 20 ppb로 제조하고 검 량선을 농도별로 작성하여 측정하였다 (Hu et al., 2008). 상 기의 방법으로 얻어진 각각의 공정별 파삼 추출물 약 10 g을 정밀히 달아 내부표준용액 1ml를 첨가하고 헥산 50ml을 넣 은 후 교반을 시켜 충분히 섞은 후 분획깔대기를 사용하여 물 층과 핵산층을 분리하는 방법을 1회로 설정하여 2회 반복한 후 헥산층을 모았다. 상기 방법으로 2회 얻어진 핵산층은 무 수황산나트륨 10 g을 넣은 여과지를 사용하여 탈수 및 여과 후 감압 농축하였다. Sep-Pak florisil cartridge에 상기의 농축 액 1ml/min의 속도로 가한 후 헥산과 디클로로메탄을 각각 5ml과 15 ml로 용출 시킨 후 40°C 이하의 온도에서 질소 가스를 가하여 날린 후 잔류물을 아세토나이트릴로 녹여 0.45µm 필터로 여과하여 사용하였다. HPLC 컬럼은 LC-PAH column (250 × 4.6㎜, I.D. particle size 5µm)를 사용하였으 며 Fluorescence Detector의 여기파장은 294㎚이고 형광파장 은 404㎚로 사용하였다. 시료는 10 µL를 주입하였으며 유속 은 1.0ml/min이었다. 이동상으로는 Acetonitrile과 Water의 혼 합액을 8 : 2로 사용하여 구배를 주지 않고 분석하였다 (Hu et al., 2008; Sung et al., 2012).
5. 통계처리
모든 실험은 3회 반복으로 행해졌으며, 실험값의 통계는 SAS (Statistical Analysis System) 프로그램을 사용하여 실험 간의 평균을 구하였으며, 각 처리구간의 최소유의차 (p < 0.05) 수준에서 통계처리 하였다.
결과 및 고찰
1. 증숙 횟수에 따른 저분자 진세노사이드 함량 비교
증숙 횟수에 따른 파삼의 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량을 분석하기 위해 건조된 파삼을 1회부터 최 종 5회까지 증숙을 하였다. 기존의 열수 추출을 이용해 얻어 진 저분자 진세노사이드 함량을 기준으로 비교 분석을 하여 파삼 증숙 공정의 최적합 조건을 선정하였다.
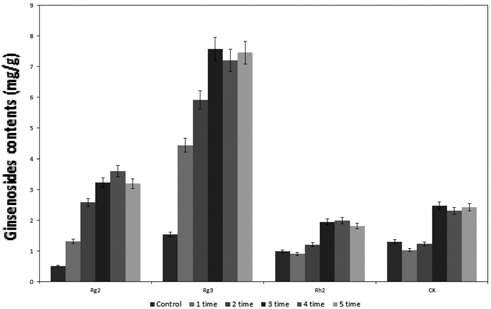
Table 1은 파삼의 증숙 횟수에 따른 저분자 진세노사이드의 양을 나타내는 결과로 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량 및 진세노사이드 총량을 비교한 결과이다. 1회 증 숙을 하였을 경우 Rg2, Rg3, Rh2, CK의 함량이 각각 약 1.318mg/g, 0.440mg/g, 0.912mg/g, 1.033mg/g로 증진되는 것 을 확인하였다. 상기의 결과는 기존의 1회 증숙하여 얻어진 진 세노사이드 Rg3의 함량인 0.42mg/g의 양과 비슷한 결과를 얻 은 것을 확인 하였다 (Kim and Kang, 2009). 또한, 매회 증 숙 횟수가 증가할수록 저분자 진세노사이드 총량이 증가하는 것을 확인 하였다. 특히, 1회 증숙에서 3회 증숙까지 횟수가 증가함에 따라 진세노사이드 총량이 대폭 증가하는 것을 확인 할 수 있었지만, 4회 5회로 증숙 횟수가 증가하면서 얻어지는 진세노사이드 총량은 3회까지 증숙 횟수가 증가함에 따라 얻 어지는 진세노사이드 총량의 증가량보다 낮은 것을 확인 할 수 있었다. 또한, 저분자 진세노사이드를 각각 분석한 결과 3 회 증숙 하였을 경우 얻어진 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량이 각각 약 2.132mg/g, 2.045mg/g, 1.332mg/ g, 1.415mg/g를 얻었으며, 5회 증숙 하였을 경우 얻어진 저분 자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량이 각각 약 2.201mg/g, 2.461mg/g, 1.413mg/g, 1.427mg/g로 거의 비슷한 농도의 저분자 진세노사이드 함량을 나타내는 것을 확인하였다.
상기의 결과를 통해 저분자 진세노사이드의 농도를 기존에 연구가 된 증숙 공정의 결과와 같이 증숙 횟수가 증가함에 따 라 저분자 진세노사이드 Rg3가 증가하며, 증가된 농도 또한 비슷하게 증가되는 경향을 확인 하였다 (Hong et al., 2007). 하지만 증숙 공정의 경우 고 에너지를 투입하여야 하는 공정 이기 때문에 다수의 증숙공정을 하는 것은 경제적이지 못하는 단점이 있다. 따라서 저분자 진세노사이드 농도 및 증숙 횟수 에 따른 결과를 바탕으로 3회 증숙 할 경우가 가장 효과적인 것으로 확인되었다.
2. 증숙 횟수에 따른 발효 공정의 진세노사이드 함량 비교 분석
증숙 횟수에 따라 얻어진 파삼을 이용하여 각각의 시료에 대해 발효를 하여 얻어진 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량을 측정한 결과를 fig 1에 나타내었다. 일반 파삼을 발효 하였을 때의 결과는 control으로 Rg2, Rg3, Rh2, CK의 함량은 각각 0.512mg/g, 1.542mg/g, 0.991mg/g, 1.303mg/g의 함량을 확인 하였다. 이는 기존의 인삼 발효의 결과인 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량은 각각 0.22mg/g, 0.10mg/g, 0.51mg/g, 2.41mg/g의 함량과 비 슷한 것을 확인 하였다 (Doh et al., 2007). 이는 기존의 발 효 방법과 증숙에 따른 발효 공정의 효과를 비교 할 수 있는 기본 결과로서 상기의 control인 일반 발효를 바탕으로 증숙 처리를 한 파삼을 발효한 결과 증숙 횟수가 1회에서 5회로 증 가하면서 저분자 진세노사이드의 함량이 점차 증진되는 결과 를 확인하였다. 특히, 5회 증숙 한 파삼의 저분자 진세노사이 드 Rg2, Rg3, Rh2, CK의 함량은 각각 3.221mg/g, 7.439mg/ g, 1.802mg/g, 2.449mg/g의 함량을 얻은 것을 확인 하였다. 하지만 증숙 횟수가 1회에서 3회까지 증가하였을 경우 저분자 진세노사이드의 함량은 3회에서 5회로 증숙 횟수가 증가함에 따라 얻어지는 저분자 진세노사이드의 함량의 증가량과 비교 하였을 경우 3회까지 증숙하고 발효를 할 경우가 가장 경제적 이고 효율적인 것으로 확인이 되었다. 3회 증숙 후 발효를 하 였을 경우 얻어지는 저분자 진세노사이드 Rg2, Rg3, Rh2, CK 의 함량은 각각 3.231mg/g, 7.585mg/g, 1.955mg/g, 2.478mg/g 인 것을 확인하였다. 따라서 증숙 발효 복합 공정의 최적합 조 건으로 선정 하였다.2
3. 중숙 발효 복합 공정의 진세노사이드 함량 분석
상기의 중숙 횟수에 따른 파삼의 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량이 높으며 가장 효과적인 공정으로 판단 된 3회 증숙한 파삼을 발효를 하여 얻어진 저분자 진세노사이 드를 측정하였다. 증숙 발효 공정의 효과를 확인하기 위해 일 반 열수 추출과 발효 공정 및 증숙 공정을 함께 측정하여 저 분자 진세노사이드 함량을 비교분석 하였다. Table 2의 결과 는 각각의 공정에 따른 저분자 진세노사이드 함량을 비교한 결과이다. 기존의 열수 추출 공정에서 얻어지는 저분자 진세 노사이드는 Rg2와 Rg3로 얻어진 양은 0.018mg/g 및 0.038mg/g으로 매우 적은양의 저분자 진세노사이드가 생성되 는 것을 확인할 수 있었다. 상기 기존의 control에 비해 발효 시 얻어지는 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함 량은 각각 0.512mg/g, 1.542mg/g, 0.991mg/g, 1.303mg/g의 함량을 얻었으며, 총 저분자 진세노사이드 함량은 약 4.348mg/g의 함량을 얻은 것을 확인 하였다. 또한 증숙 공정 을 3회 하였을 경우 얻어진 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량은 각각 2.132mg/g, 2.045mg/g, 1.332mg/g, 1.415mg/g의 함량을 얻었으며, 총 저분자 진세노사이드 함량 은 약 6.924mg/g 의 함량을 얻은 것을 확인 하였다.
상기의 결과를 바탕으로 보았을 때 일반 발효 보다는 증숙 을 하였을 경우 저분자 진세노사이드의 함량이 더 높아지는 것을 확인 할 수 있는데, 이는 발효로 인한 β-glucosidase 효 소의 생성으로 인해 β-1,2 및 β-1,4 결합의 분해로 인해 고분 자 진세노사이드에 존재하는 당이 분해되어 저분자 진세노사 이드로 전환이 되는 것보다 증숙 공정을 통한 수증기의 확산 및 침투로 인한 물리적인 가수분해를 하는 공정이 더 효과적 인 것으로 확인된다 (Zhang et al., 2001; Choi et al., 2012).
상기의 결과를 바탕으로 증숙 공정 및 발효 공정의 복합적 으로 처리하였을 경우의 파삼의 저분자 진세노사이드 함량을 측정하였다. 증숙 발효 복합 공정의 통해 파삼을 추출 할 경 우 Rg2, Rg3, Rh2, CK의 함량은 각각 3.231mg/g, 7.585mg/ g, 1.955mg/g, 2.478mg/g의 함량을 얻었으며, 총 저분자 진세 노사이드의 함량은 약 15.249mg/g의 양을 얻었다. 이는 발효 공정보다는 약 5배가량, 증숙 공정 보다는 약 2배가량 높은 양을 얻은 것을 확인하였으며, 증숙 공정과 발효공정을 복합 하여 사용할 경우 그 시너지 효과가 나오는 것을 확인 할 수 있었다. 상기의 증숙 발효 복합 공정을 통해 얻어진 저분자 진세노사이드의 양은 기존의 3회 증숙을 하였을 때 얻어진 진 세노사이드의 양인 1.74mg/g 보다 약 4배가량 증진된 결과를 얻을 수 있었다 (Kim and Kang, 2009). 또한 기존의 발효 시 얻어진 저분자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량 은 각각 0.22mg/g, 0.10mg/g, 0.51mg/g, 2.41mg/g의 함량보 다 증진된 것을 확인 하였다 (Doh et al., 2007).
이러한 결과는 증숙 공정을 통해 수증기의 확산 및 삼투의 과정이 파삼의 세포벽을 구성하고 있는 셀룰로오즈의 변화를 유도하여 파삼의 세포벽을 더욱 쉽게 파괴 할 수 있기 때문에 구조가 변형 또는 파괴되면서 발효 시 생성되는 β-glucosidase 효소가 파삼 내부로의 침투가 용이해지기 때문에 증숙 발효 복합 공정의 시너지 효과를 유도하는 것으로 판단된다 (Chen et al., 2009; Han et al., 2010).
4. 중숙 발효 복합 공정의 진세노사이드 전환 패턴 분석
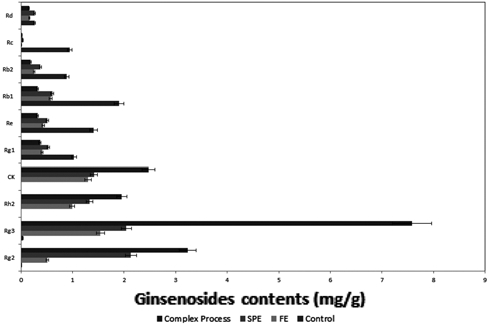
증숙 발효 복합 공정에 따른 파삼의 진세노사이드 변환 패 턴을 분석하기 위해 일반적으로 추출하는 방법인 열수 추출 방법을 기본 control로 하여, 발효 공정 및 증숙 공정에서 얻 어지는 저분자 진세노사이드로의 전환되는 양을 비교한 결과 를 그림 2에 나타내었다. 대표적으로 알려진 고분자 진세노사 이드 Rb1, Rb2, Rc, Rd 및 Rg1을 측정하였으며, 저분자 진 세노사이드로는 Rg2 Rg3 Rh2 및 CK의 양을 측정하였다. 파 삼의 열수 추출 시 얻어진 저분자 진세노사이드 Rg2와 Rg3 로 얻어진 양은 0.018mg/g 및 0.038mg/g으로 매우 적은 양 의 진세노사이드를 얻었으며, 나머지 저분자 진세노사이드인 Rh2와 CK는 검출이 되지 않았다. 또한 대표적인 고분자 진세 노사이드 Rg1은 1.029mg/g, Rb1은 1.901mg/g를 얻었다. 그 이외에 진세노사이드 Re, Rc, Rb2, Rd는 각각 적게는 0.269mg/g에서 많게는 1.411mg/g까지 진세노사이드를 얻어낸 것을 확인 하였다. 상기의 결과에서 알 수 있듯이 열수 추출 의 경우는 저분자 진세노사이드 보다 고분자 진세노사이드의 양이 많은 것을 확인하였다.
따라서 상기의 control을 바탕으로 각각의 공정의 진세노사 이드 전환 패턴을 확인 결과 발효 공정 및 증숙 공정의 경우 저분자 진세노사이드의 함량이 증가하는 것을 확인 할 수 있 었으며, 반대로 고분자 진세노사이드의 함량은 감소하는 것을 확인 할 수 있었다. 특히, 증숙 발효 복합 공정의 경우 저분 자 진세노사이드 Rg2, Rg3, Rh2, CK의 함량은 각각 3.231mg/g, 7.585mg/g, 1.955mg/g, 2.478mg/g의 함량을 얻었 고 고분자 진세노사이드 Rg1, Re, Rb1, Rb2, Rc 및 Rd의 함량이 각각 0.371mg/g, 0.320mg/g, 0.328mg/g, 0.189mg/g, 0.024mg/g 및 0.153mg/g 의 함량으로 감소하는 것을 확인 하 였다. 이러한, 상기에서 얻어진 진세노사이드 Rg2, Rg3, Rh2, CK의 총 함량은 약 15.249mg/g이며, 공정 처리를 하지 않은 파삼의 진세노사이드 Rg1, Re, Rb1, Rb2, Rc 및 Rd의 함량 의 총량인 약 6.446mg/g 보다 많은 양이 증가한 것으로 나타 나고 있다. 하지만, 기존에 알려진 인삼의 진세노사이드의 함 량에는 많은 차이가 있지만 보통 15 ~ 50mg/g의 양이 존재하 기 때문에 기타 다른 진세노사이드를 통해서도 전환이 된 것 으로 사료되며, 본 연구의 증숙 발효 복합 공정을 통해 고분 자 진세노사이드로부터 저분자 진세노사이드로의 전환이 되는 것을 확인 할 수 있었다 (Ahn et al., 2008).
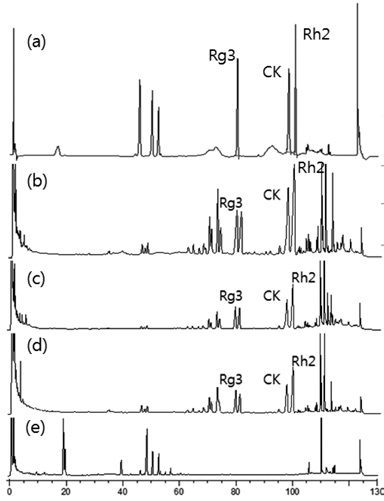
상기의 증숙 발효 복합 공정 및 각각의 공정에 따른 진세노 사이드 전환 패턴을 확인 하기위해 HPLC 크로마토그램의 결 과를 Fig. 3에 나타내었다. Control인 (d)에서는 60분 이전에 존재하는 고분자 진세노사이드의 함량이 높은 것을 확인 할 수 있으며 반대로 60분부터 100분 사이의 저분자 진세노사이 드의 함량은 적은 것을 확인 할 수 있었다. 이러한 열수 공정 을 바탕으로 발효 공정 및 증숙 공정에서는 고분자 진세노사 이드 함량이 감소하고 저분자 진세노사이드의 함량이 증가한 것을 확인 하였다. 특히, 증숙 발효 공정의 경우 저분자 진세 노사이드의 함량이 크게 증가하는 것을 확인하였다. 따라서 파 삼의 증숙 발효 복합 공정은 저분자 진세노사이드를 얻기 위 한 매우 효과적인 공정인 것으로 판단된다. Table 3
5. 증숙 발효 복합 공정에 따른 벤조피렌 함량 변화
증숙 공정을 할 경우 카라멜 반응으로 인해 생성되는 발암 물질 중 하나인 벤조피렌의 양을 측정한 결과를 표 3에 나타 내었다. 대조구 열수 추출의 경우 100°C의 온도에서 추출하기 때문에 0.06 ppb 정도의 벤조피렌이 검출 되지만 발효 공정의 경우 고온에서 처리하지 않기 때문에 0.02 ppb라는 극소량의 농도가 검출이 되었다. 하지만 증숙 공정을 5회 할 경우 얻어 지는 벤조피렌의 양은 약 0.22 ppb의 양으로 비교적 많은 양 의 벤조피렌이 검출되는 것을 확인 하였다. 하지만, 증숙 발효 공정을 적용할 경우 단 3회에 증숙이 끝나서 발효를 하기 때 문에 오히려 0.10 ppb으로 벤조피렌의 농도가 감소한 결과를 얻었다. 이러한 결과는 증숙 공정으로 인한 수증기의 확산 및 침투가 이루어 상기의 SEM 결과와 같이 파삼이 형태학적으 로 변형을 주고 발효하기에 적합한 형태로 변하기 때문에 단 3회만 증숙을 하여도 증숙을 5회 하였을 때와 비교하여 적은 양의 벤조피렌이 생성이 되고도 저분자 진세노사이드의 함량 이 더욱 증진된 것으로 판단된다 (Chen et al., 2009). 따라서, 증숙 발효 복합 공정을 통해 파삼을 추출 할 경우 벤조피 렌의 함량이 적으면서, 고농도의 저분자 진세노사이드 Rg2, Rg3, Rh2, CK 를 얻을 수 있는 매우 효과적인 공정이라고 판 단된다.
감사의 글
본 연구는 보건복지부 보건의료연구개발사업(과제고유번호: A103017)의 지원에 의하여 이루어진 것 결과로 이에 감사드 립니다.
REFERENCES
- Ahn, IO, Lee, SS, Lee, JH, Lee, MJ, Jo, BG, Comparison of ginsenoside contents and pattern similarity between root parts of new cultivars inPanax ginsengC. A. Meyer, Journal of Ginseng Research, (2008), 32, p15-18.
-
Benishin, G, Actions of ginsenoside Rb1 on choline uptake in central cholinergic nerve endings, Neurochemistry International, (1992), 21, p1-5.
[https://doi.org/10.1016/0197-0186(92)90061-u]

- Chae, JM, Maceration methods for SEM observation, Keimyung Medical Journal, (1996), 5, p75-85.
-
Chen, R, Meng, F, Zhang, S, Liu, Z, Effects of ultrahigh pressure extraction conditions on yields and antioxidant activity of ginsenoside from ginseng, Separation and Purification Technology, (2009), 66, p340-346.
[https://doi.org/10.1016/j.seppur.2008.12.026]

-
Choi, WY, Lee, CG, Song, CH, Seo, YC, Kim, JS, Kim, H, Shin, DH, Yoon, CS, Lim, HW, Lee, HY, Enhancement of low molecular ginsenoside contents in low quality fresh ginseng by fermentation process, Korean Journal of Medicinal Crop Science, (2012), 20, p117-123.
[https://doi.org/10.7783/kjmcs.2012.20.2.117]

- Choi, WY, Lee, CG, Seo, YC, Song, CH, Lim, HW, Lee, HY, Effect of high pressure and steaming extraction processes on ginsenosides Rg3 and Rh2 contents of culturedroot in wild ginseng(Panax ginsengC. A. Meyer), Korean Journal of Medicinal Crop Science, (2012), 20, p270-276.
- Doh, ES, Chang, JP, Lee, KH, Seong, NS, Ginsenoside change and antioxidation activity of fermented ginseng, Korean Journal of Medicinal Crop Science, (2007), 18, p255-265.
- Han, JG, Oh, SH, Choi, WY, Kwon, JW, Seo, HB, Jeong, KH, Kang, DH, Lee, HY, Enhancement of saccharification yield ofUlva pertusaKjellman for ethanol production through high temperature liquefaction process, Korean Society for Biotechnology and Bioengineering Journal, (2010), 25, p357-362.
- Hong, HD, Kim, YC, Rho, JH, Kim, KT, Lee, YC, Changes on physicochemical properties ofPanax ginsengC. A. Meyer during repeated steaming process, Journal of Ginseng Research, (2007), 31, p222-229.
- Hu, SJ, Jin, SH, Choi, DM, Analysis of benzo(a)pyrene in red ginseng beverage, Journal of Food Hygiene and Safety, (2008), 23, p26-30.
- Jeong, HS, Han, JG, Ha, JH, Jin, L, Oh, SH, Kim, SS, Jeong, MH, Choi, GP, Park, UY, Lee, HY, Enhancement of anticancer activities ofEphedra sinica, Angelica gigasby ultra high pressure extraction, Korean Journal of Medicinal Crop Science, (2009), 17, p102-108.
- Jeong, HS, Kang, TS, Woo, KS, Paek, KY, Yu, KW, Yang, SJ, Effects of cultured wild ginseng roots on the alcoholic fermentation, Korean Journal of Food Preservation, (2005), 12, p402-410.
- Jo, HK, Sung, MC, Ko, SK, The comparison ofginseng prosapogenin composition and contents in red and black ginseng, Korean Journal of Pharmacognosy, (2011), 42, p361-365.
- Kim, SN, Kang, SJ, Effects of black ginseng(9 timessteaming ginseng) on hypoglycemic action and changes in the composition of ginsenosides on the steaming process, Korean Journal of Food Science and Technology, (2009), 41, p77-81.
-
Lee, NR, Han, JS, Kim, JS, Choi, JE, Effect of extraction temperature and time on ginsenoside content and quality in ginseng(Panax ginseng) flower water extract, Korean Journal of Medicinal Crop Science, (2011), 19, p271-275.
[https://doi.org/10.7783/kjmcs.2011.19.4.271]

- Li, XG, Studies on the transforming mechanism of amino acid components in ginseng in the course of ginseng process, Korean Journal of Ginseng Science, (1992), 16, p64-67.
-
Singh, VK, Agarwal, SS, Gupta, BM, Immunomodulatory activity ofPanax ginsengextract, Planta Medica, (1984), 50, p462-465.
[https://doi.org/10.1055/s-2007-969773]

-
Sung, TK, Lee, JS, Lee, HG, Benzo(a)pyrene contents in commercial vegetable oils and changes during processing of vegetable oils, Korean Journal of Food Science and Technology, (2012), 44, p269-273.
[https://doi.org/10.9721/kjfst.2012.44.3.269]

- Yang, SJ, Woo, KS, Yoo, JS, Kang, TS, Noh, YH, Lee, JS, Jeong, HS, Change of korean ginseng components with high temperature and pressure treatment, Korean Journal of Food Science and Technology, (2006), 38, p521-523.
-
Yi, JH, Kim, MY, Kim, YC, Jeong, WS, Bae, DW, Hur, JM, Jun, MR, Change of ginsenoside composition in red ginseng processed with citric acid, Food Science and Biotechnology, (2010), 19, p647-653.
[https://doi.org/10.1007/s10068-010-0091-1]

-
Yu, KW, Murthy, HN, Jeong, CS, Hahn, EJ, Paek, KY, Organic germanium stimulates the growth of ginseng adventitious roots and ginsenoside production, Process Biochemistry, (2005), 40, p2959-2961.
[https://doi.org/10.1016/j.procbio.2005.01.015]

- Zhang, C, Yu, H, Bao, Y, An, L, Jin, F, Purification and characterization of ginsenoside-β-glucosidase from ginseng, Chemical and Pharmaceutical Bulletin, (2001), 49, p795-798.
-
Zhou, W, Li, J, Li, X, Yan, Q, Zhou, P, Development and validation of a reversed-phase HPLC method for quantitative determination of ginsenosides Rb1, Rd, F2, and compound K
during the process of biotransformation of ginsenoside Rb1, Journal of Separation Science, (2008), 31, p921-925.
[https://doi.org/10.1002/jssc.200700406]