복분자 열매, 잎, 줄기 추출물의 콜레스테롤과 혈압 개선 효과
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
We compared effects of fruit, leaf, and stem extracts from black raspberry on improvement of cholesterol and blood pressure in HepG2 and HUVEC cells, respectively. Cholesterol secretion was inhibited by water extracts of unripe fruit and stem, but not leaf of black raspberry in HepG2 cells. Also, water extracts of unripe fruit, leaf, and stem reduced HMG-CoA reductase activity. Furthermore, nitric oxide production and expression of angiotensin-converting enzyme (ACE) protein were regulated by extracts of fruit, leaf, and stem of black raspberry in HUVEC cells. Overall, the rank order according to the improving level of cholesterol and hypertension is as follows: stem > fruit > leaf. In addition, various polyphenol compounds displayed inhibitory effects of HMG-CoA reductase activity and ACE expression. Thus, these data suggested that leaf and stem as wells as fruit of black raspberry can be used as useful food resources for reduction of cholesterol and blood pressure.We compared effects of fruit, leaf, and stem extracts from black raspberry on improvement of cholesterol and blood pressure in HepG2 and HUVEC cells, respectively. Cholesterol secretion was inhibited by water extracts of unripe fruit and stem, but not leaf of black raspberry in HepG2 cells. Also, water extracts of unripe fruit, leaf, and stem reduced HMG-CoA reductase activity. Furthermore, nitric oxide production and expression of angiotensin-converting enzyme (ACE) protein were regulated by extracts of fruit, leaf, and stem of black raspberry in HUVEC cells. Overall, the rank order according to the improving level of cholesterol and hypertension is as follows: stem > fruit > leaf. In addition, various polyphenol compounds displayed inhibitory effects of HMG-CoA reductase activity and ACE expression. Thus, these data suggested that leaf and stem as wells as fruit of black raspberry can be used as useful food resources for reduction of cholesterol and blood pressure.
Keywords:
Black Raspberry, Cholesterol, Hypertension, Polyphenol Compounds, Nitric Oxide서 언
최근 생활수준 향상과 더불어 식생활이 서구화됨에 따라 질 병의 양상도 대사성 질환과 같은 선진국형으로 급격히 변화되 고 있다 (Lim et al., 2011). 2012년도 통계청 자료에 따르면 우리나라의 사망원인으로 암, 심장질환, 뇌혈관질환의 사망 자 수가 전체 사망자의 47% 이상을 차지하고 (National Statistical Office, 2012), 그 중 사망원인 1위는 암이나 이는 폐암, 위암, 간암 등의 여러 질환을 합한 것으로 단일질환으로 는 뇌혈관질환이 사망원인 1위라 할 수 있으며, 혈중 콜레스 테롤이나 혈압이 심장질환 및 뇌혈관질환의 주요 위험 요인이 다 (Tyroler, 2000).
대사증후군은 만성적인 대사 장애로 인하여 여러 가지 질환 이 한 개인에게서 한꺼번에 나타나는 것을 말하는데 이를 일 으키는 주요 요인으로는 고지혈증과 고혈압이 있다. 고지혈증 은 총 콜레스테롤 (total cholesterol), 중성지방 (triglyceride), 인 지질 (phospholipid) 등 혈액 내 지질의 농도가 비정상적으로 높 은 상태를 말한다. 고지혈증의 원인으로는 복합 요인에 의한 지 단백 대사 이상으로 발생하며 지방질의 과잉 섭취나 콜레스테 롤과 중성지방을 혈액 중으로 운반하는 저밀도 지단백 (low-density lipoprotein, LDL)의 발현이 증가하고 혈액내의 콜레스 테롤을 간으로 이동시켜 담즙으로 만들어 체외로 배출시키는 고밀도 지단백 (high-density lipoprotein, HDL)의 발현이 감 소하거나 리포단백의 증가, 지질 분해 감소와 같은 지방의 생 화학 대사 이상에 의해 발생하게 된다 (Moon, 1996). 고혈압은 혈관내피세포, 혈관의 평활근 및 세포의 기질의 변화로 말초 혈관의 저항이 증가되는 것을 말한다. 하지만 이러한 대사증 후군 치료 약물들은 일시적 복용이 아닌 일생동안 복용되어야 하므로 지용성 비타민 결핍증, 간기능 저하, 근병증 등의 부작 용을 동반하여 부작용 심화나 환자의 복용 거부 등의 또 다른 문제점이 발생할 수 있다. 최근에는 이러한 질환은 치료보다 예방이 필요한 질환으로 여겨져, 콜레스테롤 합성 및 고혈압 을 저해하는 생리활성 물질을 천연물로부터 찾아내려는 연구 가 활발하게 진행되고 있으며, 치료 효과에 대한 관심이 높아 져 이에 대한 수요도 증가하고 있는 추세이다 (Yotsumoto et al., 1997; Kim et al., 2001; Mckenny, 2001; Miettinen, 2001; Shin and Han, 2002).
전국 최대 생산지인 고창을 비롯하여 전국적으로 재배되어 지고 있는 복분자 (Rubus occidentalis) (Eu et al., 2008)는 높은 농도의 총 안토시아닌과 총 페놀 화합물로 강한 항산화 력을 보여주며 (Wang and Lin, 2000), 항암활성 (Eu et al., 2008), 면역증진효과 (Seeram et al., 2006) 등 다양한 생리활 성에 대한 연구가 활발히 이루어지고 있다.
지금까지 복분자 열매에 관한 많은 연구가 진행되었으나, 부 산물인 잎, 줄기에 관한 연구는 많이 진행되지 않았다. 복분자 잎과 줄기에서는 탄닌과 플라보노이드 화합물 등이 보고되었 으나 (Lee et al., 2003), 기능적 효과에 대해서는 연구가 아 직 미비한 실정이다. 인삼에서 뿌리와 비교했을 때, 잎과 줄기 에서 보다 많은 양의 진세노사이드, 다당류, 트리테르펜 폴라 보노이드, 펩타이드, 아미노산 및 지방산과 같은 활성 성분을 가졌다고 (Xie et al., 2004) 보고 하였고 Kim 등 (2011) 연 구 결과에서도 과육과 더불어 인삼 잎이 진세노사이드 및 폴 리페놀성 물질이 다량 함유되어 있어 항산화제를 비롯한 기능 성 개발 소재로 충분한 가치가 있다고 보고되었다. 복분자의 생산 과정에서 부산물로 나오는 잎이나 줄기에도 열매와 비슷 한 성분이 있다고 추측하여 복분자 부산물에도 관심을 가질 필요가 있다고 사료된다.
이에 본 연구는 복분자 재배과정 중 버려지는 복분자의 잎, 줄기 부산물을 이용하여 콜레스테롤 및 혈압개선에 대한 기능 성 비교 연구를 통하여 기초 자료를 확보하고 나아가 이를 이 용하여 다양한 활용방안을 모색하고자 연구를 수행하였다.
재료 및 방법
1. 세포주와 세포배양
복분자 열매, 잎, 줄기 추출물이 혈중 콜레스테롤과 혈중지 질 구성성분인 HDL, LDL의 생성에 관련된 유전자의 발현에 미치는 영향을 알아보기 위해 인간 간암 세포주 (human liver hepatocellular carcinoma cell line)인 HepG2 세포를 실험에 사용하였고 혈압개선 효과를 확인하기 위해서는 인간제대정맥 내피 세포주 (human umbilical vein endothelial cell line)인 HUVEC 세포를 사용하였다. HepG2, HUVEC cell line 모두 한국세포주 은행에서 분양받았으며, HepG2 세포는 Dulbcco’s Modified Eagle Media (DMEM, Welgene, Daegu, Korea), HUVEC 세포는 RPMI 1640 media (Welgene)에 56°C에서 30분간 열처리된 10% fetal bovine serum (PAA Labortories Inc., Etobicoke, Ontario, Canada)과 항생제 (penicillin/ streptomycin, Lonza, Walkersville, MD, USA) 1%를 첨가하 여 37°C, 습도 90%, 5% CO2 배양기에서 배양하였다.
2. 추출물 제조
복분자 미숙과, 완숙과, 줄기, 잎 중량의 10배 용량의 용매 (물과 25, 50, 75% 에탄올)를 첨가한 후 2시간 동안 농축 추 출기 (Cosmo 660, Kyungseo machine, Incheon, Korea)를 이 용하여 2회 가열 추출하였다. 추출물은 여과하여 농축한 후 동 결건조 (PVTFD10R, Ilsinbiobase, Dounducheon, Gyeonggido, Korea)하여 사용하였다.
3. 세포독성실험 (MTT Assay)
세포의 생존율은 Mosmann의 방법 (Mosmann, 1983)에 따 라 MTT [3-(4,5-dimethylthiazole-2-yl)-2, 5-diphenyl-tetrazolium bromide] 환원법을 이용하여 측정하였다. MTT assay는 세포 독 성 정도를 측정하는 방법으로 미토콘드리아의 탈수소 효소작용 에 의해 노란색의 수용성 기질인 MTT tetrazolium을 청자색 을 띄는 비수용성의 MTT formazan으로 환원시키는 방법을 이용하여 450㎚의 파장에서 흡광도가 최대가 되며, 이 파장 에서 살아있는 세포수를 반영한다. HepG2 세포는 96 well에 1 × 104 cells/ml 농도로 90µl씩 분주 한 뒤 37°C, 5% CO2 배양기에서 24시간 동안 배양하였다. 이후 복분자 열매, 잎, 줄기 추출물들을 농도별로 제조하여 처리한 후 24시간 동안 배양기에서 배양하였다. 같은 방법으로 HUVEC 세포 또한 96 well에 2 × 104 cells/ml 농도로 90µl씩 분주하고, 복분자 열매, 잎, 줄기 추출물들을 농도별로 제조하여 처리한 뒤 24시간 동 안 배양기에서 배양 하였다. MTT assay에는 cell viability assay kit (EZ-Cytox, Daeil, Seoul, Korea)를 사용하였고, 모 든 well에 MTT용액 10µl를 첨가하여 37°C, 5% CO2 배양 기에서 4시간 동안 배양한 뒤 microplate reader (Synergy HT, Bio-Tek, Winooski, VT, USA)를 이용하여 450㎚에서 흡광도를 측정하였다.
4. 콜레스테롤 생성 억제 효과
HepG2 세포를 6 well에 3 × 105 cells/ml로 분주하여 24시간 배양 후, 복분자 열매, 잎, 줄기 추출물별로 처리하였다. 24 시간 후 세포배양액을 centrifucal filter units (Vivaspin 4, Sartorius stedium, Goettingen, Germany)를 사용하여 농축시 켰다. 콜레스테롤의 총 양은 콜레스테롤 정량 키트 (Cholesterol/cholesterol ester quantitation kit, BioVision, Mountain View, CA, USA)를 사용하여 측정하였다. 시료와 reagent를 섞어 빛 을 차단 후 37°C에서 1시간 동안 배양하여 microplate reader (Bio-Tek)를 이용하여 530/590㎚에서 측정하였다.
5. 총 폴리페놀과 총 플라보노이드 함량 측정
총 폴리페놀 함량은 페놀성 물질인 phosphomolybdic acid 와 반응하여 청색을 나타내는 원리를 이용한 Folin-Denis 방 법 (Singleton and Rossi, 1965)을 이용하여 측정하였다. 복분 자 열매, 잎, 줄기 추출물 1ml에 Folin-Ciocalteu’s phenol reagent 1ml를 가하고 3분간 반응 시킨 다음 10% Na2CO3 1ml를 넣고 1시간 동안 실온에서 반응시킨 후 UV/VIS spectrophotometer (UV-2450, Shimadzu Co., Kyoto, Japan) 를 사용하여 700㎚에서 비색정량 하였다. 이때 gallic acid (Sigma-Aldrich Co., St. Louis, Mo, USA)를 표준물질로 사 용하여 검량곡선을 작성하고 이로부터 총 페놀 함량을 구하 였다. 총 플라보노이드 함량은 Chang 등 (2002)의 방법을 응 용하여 측정하였다. 시료액 1ml에 diethylene glycol 2ml, 1 N-NaOH 0.02ml를 가한 다음 37°C 항온수조에서 1시간 동안 반응시킨 후 UV/VIS spectrophotometer (UV-2450, Shimadzu Co., Kyoto, Japan)를 사용하여 420㎚에서 흡광도를 측정하 였다. 이때 총 플라보노이드 함량은 rutin (Sigma-Aldrich Co., St. Louis, Mo, USA)을 표준물질로 사용하여 검량곡선을 작성하고 이로부터 총 플라보노이드 함량을 구하였다.
6. Polyphenol Compounds 함량분석
복분자 추출물의 polyphenol compounds 함량을 분석하기 위하여 10개 표준품 (Sigma-Aldrich Co., St. Louis, Mo, USA)을 구입하여 HPLC (Agilent, Palo Alto, CA, USA)를 이용 Table 1의 조건으로 함량을 분석하였다.
7. HMG-CoA Reductase 활성 억제효과
3-hydroxy-3-methylglutaryl-CoA (HMG-CoA) reductase는 콜레스테롤 생합성에 중요하게 작용하는 효소로 현재 동맥경 화 치료에 사용되어지고 있는 statin 계열의 약물들은 HMG-CoA reductase의 저해제로 작용하고 있다. 양성대조군으로 HMG-CoA reductase의 저해제인 pravastatin을 사용하였고, 복 분자 열매, 잎, 줄기 물 추출물과 폴리페놀 단일성분 10가지를 HMG-CoA reductase activity assay kit (Sigma-Aldrich Co., St. Louis, Mo, USA)를 사용하여 HMG-CoA reductase 활성 억제 정도를 측정하였다.
8. RNA Purification과 cDNA Preparation
HepG2 세포를 6 well 3 × 105 cells/ml로 분주하여 48시간 배양 후, 복분자 열매, 잎, 줄기 물 추출물을 처리하여 LDL 및 HDL 관련 유전자 발현 변화를 확인하였다. RNA 추출은 total RNA extraction reagent인 Tri-reagent (RNAiso PLUS, TAKARA, Otsu, Japan)를 사용하여 1ml을 세포에 넣은 후 15초 동안 vortex하여 15분간 상온에 방치하였다. 이후 chloroform 200µl를 넣고 20초간 vortex하여 다시 상온에서 5분 동안 방치하여 15,000 rpm에서 5분간 원심 분리한 후 상 층액을 새로운 튜브에 옮겼다. 동량의 isopropanol를 넣고 상 온에서 10분 동안 방치하였다. 이를 15,000 rpm에서 10분 간 원심 분리하여 RNA 침전물을 얻었다. RNA 침전물을 75% 에탄올로 씻은 후, 침전물을 실온에서 건조시켜 0.1% diethyl pyrocarbonate (DEPC) water에 녹였다. RNA 농도 (1 OD=40µg/ml)는 spectrophotometer (DUR730spectrophotometer, Beckman, Fullerton, CA, USA)를 이용하여 260㎚에서 측정하 였다.
First strand cDNA을 50 mM Tris-HCl (pH 8.3), 75 mM KCl, 3 mM MgCl2, 10 mM DTT (Invitrogen, Carlsbad, CA, USA), 1 U/µl RNasin (Invitrogen), 1mM each dNTP, oligo (dT)20 100 ng과 MMLV reverse transcriptase (Invitrogen) 200U가 함유된 20µl의 용액에서 총 RNA 2µg으로부터 합 성하였다. cDNA를 합성 한 뒤, LDL 생성 관련 인자인 LDL 수용체와 전사인자인 sterol regulatory element binding protein-1 (SREBP-1), sterol regulatory element binding protein-2 (SREBP-2), HMG-CoA reductase mRNA 발현 정 도와 HDL 관련 인자인 콜레스테롤 transporter ATP binding cassette transporter A1 (ABCA1), scavenger receptor class B, type I (SR-B1) mRNA의 발현 정도를 확인 하였다. 실시 간 역전사 중합효소 연쇄반응은 Fast Start DNA Master SYBR Green I kit (Roche, Mannheim, Germany)를 이용하 여 Light Cycler 2.0 (Roche, Mannheim, Germany)에서 증 폭하였다. 실험에 사용된 primer와 PCR 조건은 Table 2, 3와 같으며 유전자의 정량분석은 Light Cycler Software 4.0 (Mannheim, Germany, Roche)을 이용하였다.
일산화질소 (Nitric oxide, NO)는 혈관내막 (endothelium)에 서 생산되는 물질로서 혈관을 확장시키는 물질로 알려져 있다.
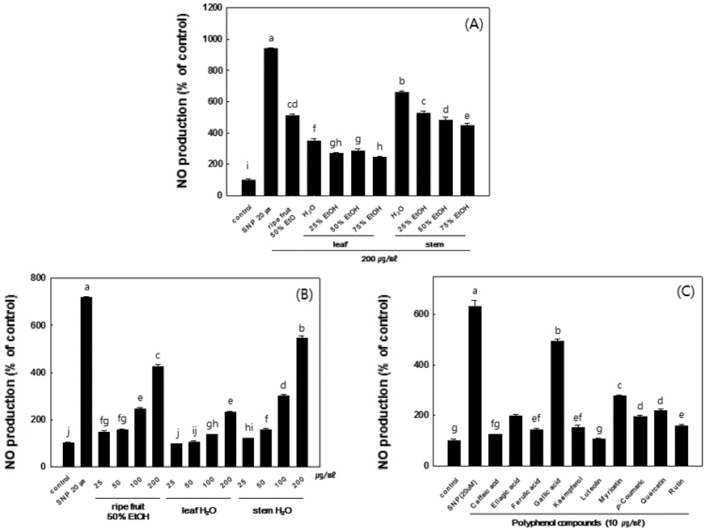
양성대조군으로 동맥과 정맥 평활근에 강력히 작용하여 혈관 이완제로 쓰이는 약물인 sodium nitroprusside (SNP, Sigma-Aldrich Co.)를 사용하였다. HUVEC 세포를 12 well culture dish에 1 × 105 cells/ml의 농도로 분주하여 24시간 배양한 뒤 복분자 열매, 잎, 줄기를 처리하였고, 24시간 뒤 세포배양액을 획득하였다. 대조군인 SNP 또한 같은 방법으로 배양액을 획 득하였다. 처리군의 세포 배양액 상층액 150µl와 20µl의 griess reagent 시약과 130µl의 H2O 혼합물을 상온에서 30분 간 반응시켰다. 이후 반응물의 흡광도는 microplate reader (Bio-Tek)을 사용하여 흡광도 548㎚에서 측정하였다. 아질산 염 (NO2)의 농도 정도는 아질산염의 표준곡선으로부터 계산 하였다. 복분자 잎과 줄기 추출물별, 추출물의 농도별로 NO 생성을 확인하였고, 폴리페놀 단일물질과도 비교하였다.
HUVEC 세포를 60㎜ dish에 6 × 105 cells/ml의 농도로 24 시간 동안 배양 후 복분자의 angiotensin converting enzyme (ACE) 억제능력과 endothelial Nitric Oxide Synthase (eNOS) 발현능을 확인하였다. 실험에 사용된 추출물은 NO 생 성 결과를 바탕으로 잎 물 추출물과, 줄기 물 추출물, 그리고 복분자 완숙과 50% 에탄올 추출물을 200µg/ml의 농도로 사 용하였다. 양성대조군으로 ACE inhibitor로 알려져 있는 captopril을 처리하였다. 복분자 열매, 잎, 줄기 추출물과 captopril 처리 24시간 후 차가운 PBS로 dish를 washing하고 lysis buffer를 dish에 뿌린 후 스크래퍼를 이용하여 세포를 획 득 하였다. 단백질 추출을 위해 30분 동안 5분에 한번씩 vortex mixing을 하였고, 13,000 rpm으로 15분 동안 원심분리 를 하여 상층액을 획득 하였다. Bradford 정량법 (Bradford, 1976)을 이용하여 단백질 정량을 시행하였고, SDS-page gel에 loading 하였다. Loading을 마친 후 trans-Blot® Turbo™ (Biorad, Hercules, CA, USA)를 이용해 PVDF membrane (Biorad) 에 단백질을 transfer 시킨 후 5% blocking buffer (Sigma- Aldrich Co.)를 사용해 blocking 과정을 진행하였다. Transfer된 membrane을 1 × TBS-T로 washing 후 5% blocking buffer에 1차 antibody (ACE, eNOS; Santacruz, Dallas, TS, USA)를 희석하여 4°C에서 overnight 시켰다. 다음날 1 × TBS-T로 membrane을 washing 한 뒤 2차 antibody (Santacruz)를 4°C 에서 1시간 반응 시켰다. 이를 다시 1 × TBS-T로 washing 후 ECL western blotting substrate (Promega, Gaithersburg, MD, USA)로 단백질의 발현정도를 확인하였다.
모든 분석 자료는 평균±표준오차 (mean ± SE)로 나타내었 으며 실험결과는 SPSS 12.0K (SPSS Inc., Chicago, IL, USA)를 이용하여 p < 0.05 수준에서 통계처리 하였고 Duncan’s Multiple Range Test (DMRT)로 검증하였다.
결과 및 고찰
1. 간암세포주와 혈관내피세포주에서 복분자 열매, 잎 및 줄 기 추출물의 세포독성
간암세포주인 HepG2 세포와 혈관내피세포주인 HUVEC 세 포에서 복분자 열매, 잎 및 줄기 추출물을 세포독성을 조사 하였다. 복분자의 열매 (미숙과 및 완숙과), 잎 및 줄기의 물 추출물과 25, 50, 75% 에탄올 추출물 모두 100µg/ml, 200µg/ml의 농도에서 세포독성을 보이지 않았다 (Fig. 1).
2. 복분자 열매, 잎 및 줄기 추출물의 혈중지질 개선 효과
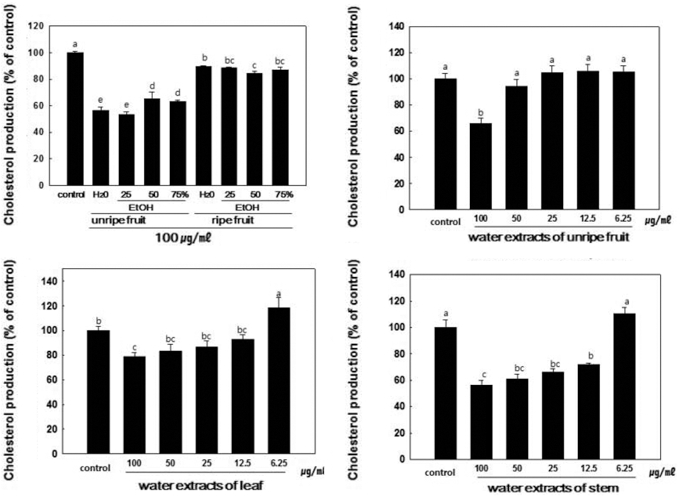
복분자 열매, 잎 및 줄기 추출물의 콜레스테롤 생성 억제 효과를 비교하기 위하여 간세포주인 HepG2 세포를 이용하였 다. 실험결과, 복분자 열매의 경우 100µg/ml의 농도에서 미 숙과와 완숙과 추출물을 비교하였을 때 완숙과에 비해 미숙과 추출물이 보다 높은 콜레스테롤 합성 억제 효과를 나타내었다 (Fig. 2). 복분자 부산물인 잎과 줄기의 물 및 에탄올 추출물 의 콜레스테롤 생성효과를 비교한 결과, 잎의 물과 에탄올 추 출물은 콜레스테롤 합성 억제 효과가 약하였지만, 줄기는 물 추출물과 75% 에탄올 추출물에서 35% 정도로 가장 높은 콜 레스테롤 생성 억제 효과를 나타내었고, 제조공정상의 재료비 절감과 추출수율을 고려하였을 때 향후 수행될 연구에 복분자 열매, 잎 및 줄기의 물 추출물을 이용하였다 (data not shown). 복분자 미숙과, 잎 및 줄기 물 추출물의 농도별 콜레 스테롤 생성 억제효과를 측정한 결과, 100µg/ml의 농도에서 미숙과, 잎, 줄기 추출물이 각각 35%, 20%, 44% 억제효과를 보여 줄기가 콜레스테롤 합성 억제 효과가 더 뛰어난 것으로 밝혀졌다 (Fig. 2).
복분자 열매, 잎, 줄기 추출물들의 총 폴리페놀과 총 플라보 노이드 함량을 조사하였다 (Table 4). 총 폴리페놀과 총 플라 보노이드 함량은 줄기 물 추출물 >잎 물 추출물 >미숙과 물 추출물 >완숙과 50% 에탄올 추출물 순으로 동일하게 확인되 었다. Kwon 등 (2011)의 연구 결과와 비슷한 함량을 나타내 었다. 복분자 부위별 추출물에 대한 페놀성 화합물을 분석한 결과 ellagic acid와 gallic acid의 함량이 높게 나타났으며, rutin, quercetin, ferulic acid, p-coumaric acid, caffeic acid, luteolin, myricetin 등 다양한 페놀 화합물이 분석되었다 (Table 5).
식물체에 존재하는 많은 생리 활성 물질 중 페놀 화합물은 2차 대사산물로서 분자 내에 하나 이상의 phenolic hydroxyl기 를 가지고 있어서 단백질 및 거대분자들과 결합하는 성질이 있으며 2가 금속 이온과의 결합력과 수소 공여 작용을 통해 free radical을 제거함으로써 높은 항산화 효과를 가지는 것으 로 알려져 있다 (Lee et al., 2008; Kwak et al., 2010). 복 분자 열매, 잎, 줄기 추출물 중에서는 줄기 물 추출물이 가장 높은 항산화 효과가 있는 것으로 사료된다.
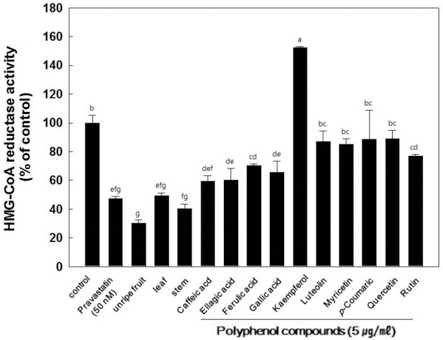
HMG-CoA reductase는 콜레스테롤 생합성 과정에 중요하게 작용하는 효소로 현재 동맥경화 치료에 사용되어지고 있는 statin 계열의 약물들은 HMG-CoA reductase의 저해제로 작용 하고 있다. 따라서 HMG-CoA reductase의 활성을 조절하면 혈중 콜레스테롤의 수치를 조절할 수 있다는 사실을 바탕으 로 복분자 미숙과, 잎 및 줄기 물 추출물의 HMG-CoA reductase 억제활성을 비교한 결과, 양성대조군이자 HMG-CoA reductase 저해제인 pravastatin은 약 55%의 억제활성을 보였 고, 미숙과, 잎 및 줄기 물 추출물은 각각 70%, 51%, 60% 의 억제효과를 보였다 (Fig. 3).
결과적으로 HMG-CoA reductase activity 억제 활성 비교 에서는 복분자 미숙과가 가장 높은 억제활성을 보였고, 다음 으로 줄기, 잎 추출물 순으로 억제 효과를 보였다.
복분자는 폴리페놀 성분이 풍부하다고 알려져 있는데, 10가 지의 폴리페놀 단일물질을 이용하여 HMG-CoA reductase 활 성 억제효과를 조사한 결과, 10가지 폴리페놀 단일물질 중에 서 caffeic acid 40%, ellagic acid 40%, gallic acid 34%, ferulic acid 30%의 억제효과를 나타내었다. 나머지 6가지의 단일물질은 HMG-CoA reductase 활성 억제에 미치는 영향이 적은 것으로 나타났다. 다른 연구 결과에서도 포도씨에 함유 된 폴리페놀 중 gallic acid가 혈중 콜레스테롤 억제에 효과가 있음을 증명하였고 (Ngamukote et al., 2011), 녹차와 홍차 추출물이 HMG-CoA reductase 활성 및 콜레스테롤 합성 억 제 효과가 있다고 밝혔지만, 녹차의 단일물질인 epicatechin, ECG, EGC, ellagic acid, gallic acid에서는 콜레스테롤 합성 억제 효과는 보이지 않는다고 보고하였다 (Singh et al., 2009).
이상의 콜레스테롤 합성 억제 효과와 HMG-CoA reductase 활성 억제 효과를 종합해 보면, 복분자 미숙과와 줄기 물 추 출물이 가장 높은 콜레스테롤 개선효과가 있음을 확인할 수 있었고, 이러한 결과를 바탕으로 복분자 부산물인 잎, 줄기 또 한 혈중지질 개선 효과를 나타냄을 알 수 있었다.
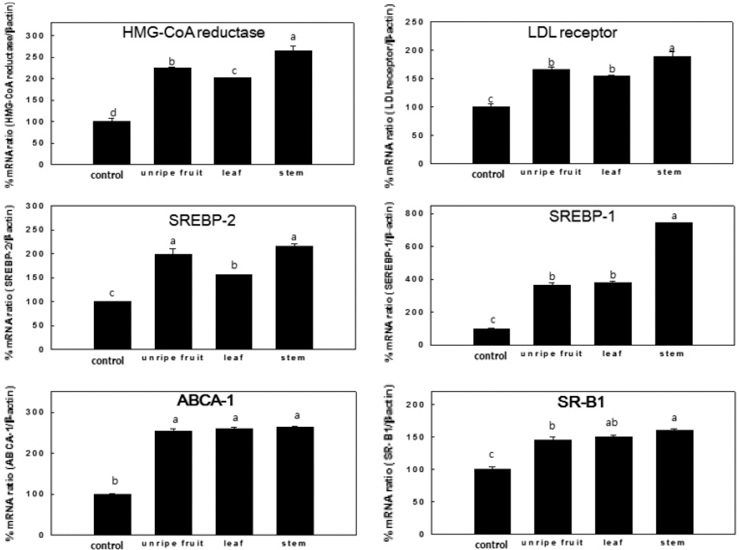
인간간암세포주인 HepG2 세포에서 복분자 열매, 잎 및 줄 기 추출물을 배지 내에 첨가한 뒤 48시간 동안 배양하여 real-time PCR을 통해 LDL 및 HDL 유전자 발현을 조사하 였다 (Fig. 4). LDL 관련 유전자를 확인해본 결과 HMG-CoA reductase mRNA 발현은 복분자 미숙과, 잎, 줄기 물 추출물이 각각 2.2배, 2배, 2.6배로 줄기가 가장 많이 증가 하 였다.
HMG-CoA reductase 억제제인 statin 계열의 약물들은 HMG-CoA reductase의 활성은 감소시키지만, 감소된 콜레스 테롤에 대한 항상성 유지를 위해 HMG-CoA reductase 유전 자의 발현은 증가하게 된다 (Pal et al., 2003).
복분자 미숙과, 잎, 줄기 물 추출물을 100µg/ml 처리했을 때 LDL receptor (LDLR)의 발현을 각각 1.6배, 1.5배, 1.8배, SREBP-2는 각각 2.0배, 1.5배, 2.2배, SREBP-1은 3.6배, 3.7 배, 7.4배 증가시켜, 줄기, 미숙과, 잎 물 추출물 순으로 높은 유전자 발현양상을 보였다 (Fig. 4).
간세포는 콜레스테롤 양이 많아지면 콜레스테롤 생산을 줄 이거나 느리게 진행시켜 혈중 콜레스테롤 합성을 조절한다. 혈 중 지단백질은 크게 LDL과 HDL로 나뉘는데 LDL은 혈관에 쌓이는 지질단백질로서, 혈중 콜레스테롤의 약 3/4를 형성하 고 (Mahley et al., 1984), 간에서 조직과 세포로 콜레스테롤 을 운반한다. 콜레스테롤 자체로는 인간 건강에 크게 위협적 이지 않지만 LDL에 같이 포함되어 있어서 건강지표로 이용 된다. HDL은 세포에서 소모되지 않은 과량의 콜레스테롤을 조직에서 다시 간으로 운반해주며, 운반된 콜레스테롤은 간에 서 분해되어 담즙산으로 분비되고 산화 LDL의 결합 수용체 로 알려졌던 SR-B1에 결합한다 (Steinberg, 1996). 주로 LDL 에 붙어 있는 콜레스테롤이 동맥경화를 유발시키는 반면 HDL 은 동맥경화를 지연시키거나 감소시킨다. 세포 내 콜레스테롤 의 생합성은 acetyl-CoA 3개 분자가 결합하여 HMG-CoA, mevalonic acid 등의 과정을 거쳐 이루어지는데, 이때 HMGCoA reductase가 효소로 쓰이게 된다. 콜레스테롤 합성을 조 절하는 HMG-CoA reductase가 세포 내 콜레스테롤 농도에 따라 상호 발현을 조절함으로써 균형이 결정된다 (Taniguchi et al., 1994). LDL receptor는 혈중 콜레스테롤을 제거하고 세포 내 콜레스테롤 양에 따라 발현이 조절되어 균형을 유지 하는데 중요한 역할을 한다. 혈중 콜레스테롤이 증가하면 LDLR 유전자 발현을 조절하는 SREBPs의 발현이 증가하고, 증가된 SREBPs 유전자는 LDLR의 발현을 증가시켜 세포 내 로의 콜레스테롤 흡수를 촉진하여 혈중 콜레스테롤 농도를 낮 춘다. 또한, LDLR의 발현은 콜레스테롤 농도를 낮출뿐만 아 니라 세포 내 콜레스테롤 항상성을 유지하기 위해 HMG-CoA reductase의 발현을 증가시킨다고 알려져 있다 (Pal et al., 2003).
SREBP isoform은 SREBP-1a, 1c, 2의 세 가지가 있으며, SREBP-1a와 SREBP-1c는 주로 지방산 합성에 관여하며 (Brown and Goldstein, 1997), 간세포에서의 중성지방 합성과 관련된 유전자의 발현을 조절하고 (Horton et al., 2002), SREBP-2는 콜레스테롤 합성과 대사에 관여한다고 알려져 있 다 (Han et al., 2002). HepG2 세포에 적포도주나 이소플라 본을 함유하는 콩 추출물을 처리하였을 때 LDLR와 SREBPs 발현을 증가시켜 혈중 콜레스테롤의 농도를 낮추는데 효과를 나타내었다 (Pal et al., 2003; Mullen et al., 2004).
HDL 관련 유전자인 ABCA1 및 SR-B1 mRNA 발현에 미 치는 영향을 HepG2 세포에 추출물별로 100µg/ml의 농도로 처리하여 조사한 결과, 복분자 미숙과, 잎, 줄기 모두 ABCA1 은 약 2.5배, SR-B1은 1.5배로 증가하여 비슷한 효과를 보였 다 (Fig. 4). ABCA1은 HDL 콜레스테롤 운송에 관여하는 것 으로 보고되어졌으며 (Aiello et al., 2003; Joyce et al., 2003), 세포의 콜레스테롤과 인지질의 항상성을 조절한다. 따 라서 ABCA1의 발현이 증가하게 되면 혈중 HDL의 농도가 증가하여 콜레스테롤이 체외로 배출되어 체내의 콜레스테롤이 낮아진다. SR-B1은 체내 콜레스테롤 대사에 있어서 HDL의 선택적 흡수에 관여하고 간과 지방대사 조직에 가장 많이 분포 하고 있으며 콜레스테롤을 간을 통해 체외로 배출하여 동맥경 화에 대응하는 기작을 가지고 있다고 알려져 있다 (Krause and Auerbach, 2001; Brundert et al., 2006). 커피의 caffeic acid, ferulic acid에서 ABCG1과 SR-B1의 발현이 증가함으로써 HDL 콜레스테롤이 증가한다고 보고하였다 (Uto-Kondo et al., 2010). 즉 LDL 및 HDL 관련 mRNA 발현능을 확인한 결과, 복 분자 줄기, 미숙과, 잎 물 추출물 순으로 혈중지질 개선에 효 과가 높은 것으로 사료된다.
3. 복분자 열매, 잎 및 줄기의 혈압 개선 효과
HUVEC 세포에서 복분자 열매, 잎 및 줄기의 NO 생성능 을 비교하였다 (Fig. 5). 예비실험 결과, 복분자 열매인 완숙과 와 미숙과의 물과 에탄올 추출물의 NO 생성을 비교해 보았을 때 완숙과 50% 에탄올 추출물에서 높은 NO 생성을 보여 열 매는 50% 에탄올 추출물을 사용하였다 (data not shown). 그 리고 복분자 부산물인 잎과 줄기의 물과 에탄올 추출물의 NO 생성을 비교한 결과, 줄기가 잎 보다는 높은 NO 생성을 보였 고, 물과 에탄올 추출물간 큰 차이를 보이지 않아 물 추출물 을 선택하여 연구를 진행하였다.
복분자 완숙과, 잎, 줄기 추출물 농도별로 생성되는 NO의 양 을 측정해본 결과, 잎과 줄기 추출물 모두에서 25 ~ 200µg/ml 로 추출물의 처리 농도가 증가함에 따라 NO의 생성량이 증가 되었다. 그 중에서도 특히 줄기 물 추출물의 NO 생성량이 가 장 높게 측정 되었고 (5.5배), 복분자 완숙과 50% 에탄올 추 출물 (4.3배), 잎 물 추출물 (2.3배)의 순으로 높은 NO 생성 효과를 나타내었다. 폴리페놀 단일물질은 caffeic acid, ellagic acid, ferulic acid, gallic acid, kaempferol, luteolin, myricetin, p-coumaric acid, quercetin, rutin 총 10가지를 이용하여 10µg/ml의 농도로 처리하여 NO 생성을 확인한 결과, gallic acid는 control 그룹과 비교하여 4.9배, myricetin은 2.8배의 NO 생성을 나타내었고 그 밖의 8가지 단일물질의 NO 생성 효과는 미미하였다.
내피의존성이완물질은 NO로 알려져 있으며, 혈관내피세포 에서 eNOS에 의하여 L-arginine으로부터 합성되고, 이에 합성 된 NO는 혈관 평활근에서 soluble guanylyl cyclase를 활성화 시켜 3’, 5’-cyclic guanosine monophosphate를 증가시킴으로 써 세포 내 Ca2+ 농도를 감소시켜 혈관을 이완시킨다고 알려 져 있다 (Busse et al., 1993; Horowits et al., 1997).
Godse 등 (2010)은 fructose 유도 고혈압 동물모델에서 angiotensin II를 억제하여 myricetin이 혈압을 감소시킨다고 보고하였고, Sarr 등 (2006)의 연구 결과에서는 gallic acid 및 caffeic acid를 함유하는 적포도주 추출물을 이용하여, angiotensin II로 유도된 고혈압 동물에서 적포도주 추출물이 내 피세포의 기능장애를 억제하고 NADPH 산화 효소의 유도를 억 제하지만 혈압의 변화에는 영향을 미치지 않았다고 보고하였다.
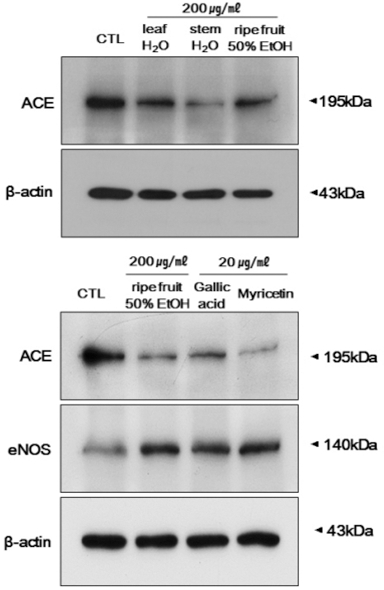
복분자 완숙과 50% 에탄올 추출물과 잎과 줄기 물 추출물 을 200µg/ml의 농도로 사용하여 ACE와 eNOS 단백질 발현 를 조사하였다. 그 결과, 줄기 물 추출물을 처리한 그룹에서 ACE 단백질 발현이 가장 큰 억제효과를 보였으며, 복분자 열 매와 잎 추출물을 처리한 그룹에서는 비슷한 ACE 단백질 발 현 억제 효과를 보였다 (Fig. 6).
ACE는 신장 또는 폐에서 분비되며, angiotensin I을 angiotensin II로 전환시키는 효소로 혈압조절에 가장 중요하게 작용하고 있고 (Atlas, 2007), eNOS는 칼슘의존성으로 국소적 혈류, 동맥혈압, 혈관장력 조절에 관련되어 평활근을 확장시키 고, 혈소판 응축을 억제시키는 유용한 인자이다 (Thomsen et al., 1995). 10가지의 폴리페놀 단일 물질 중 NO 생성효과가 뛰어난 gallic acid와 myricetin 20µg/ml를 처리하여 eNOS 발현을 확인하였다. 복분자 완숙과, gallic acid, myricetin 모 두 비슷하게 eNOS 발현이 증가함을 확인 할 수 있었고, eNOS 발현 증가가 NO 생성을 증가시켜 혈압에 개선 효과를 나타내는 것으로 사료된다.
위 결과를 종합해보면, 복분자 완숙과, 잎 및 줄기 추출물의 혈압개선 효과를 비교한 결과, 줄기, 완숙과, 잎의 순으로 NO 생성, ACE 단백질 발현 억제 및 eNOS 증가 효과가 뛰어났 을 뿐만 아니라, 단일 물질인 gallic acid와 myricetin 또한 혈 압 개선에 효과가 있음을 확인하였다.
감사의 글
본 연구는 (재)고창복분자연구소 건립사업의 일환으로 수행 된 결과로 이에 감사드립니다.
REFERENCES
- Aiello, RJ, Brees, D, Francone, OL, ABCA1-deficient mice: Insights into the role of monocyte lipid efflux in HDL formation and inflammation, Arteriosclerosis Thrombosis and Vascular Biology, (2003), 23, p972-980.
-
Atlas, SA, The reninangiotensin aldosterone system: Pathophysiological role and pharmacologic inhibition, Journal of Managed Care Pharmacy, (2007), 13, p9-20.
[https://doi.org/10.18553/jmcp.2007.13.s8-b.9]

-
Bradford, MM, Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analytical Biochemistry, (1976), 72, p248-254.
[https://doi.org/10.1006/abio.1976.9999]

-
Brown, MS, Goldstein, JL, The SREBP pathway: Regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor, Cell, (1997), 89, p331-340.
[https://doi.org/10.1016/s0092-8674(00)80213-5]

-
Brundert, M, Heeren, J, Bahar, BM, Ewert, A, Moore, KJ, Rinninger, F, Selective uptake of HDL cholesteryl esters and cholesterol efflux from mouse peritoneal macrophages independent of SR-BI, Journal of Lipid Research, (2006), 47, p2408-2421.
[https://doi.org/10.1194/jlr.m600136-jlr200]

- Busse, R, Mulsch, A, Fleming, I, Hecker, M, Mechanism of nitric oxide release from the vascular endothelium, Circulation, (1993), 87, p18-25.
- Chang, CC, Yang, MH, Chen, JC, Estimation of total flavonoid content in propolis by two complementary colorimetric methods, Journal of Food and Drug Analysis, (2002), 10, p178-182.
- Eu, GS, Chun, BY, Bandopadhyay, R, Yoo, NH, Choi, DG, Yun, SJ, Phylogenic relationships of Rubus species revealed by randomly amplified polymorphic DNA markers, Journal of Crop Science and Biotechnology, (2008), 11, p39-44.
-
Godse, S, Mohan, M, Kasture, V, Kasture, S, Effect of myricetin on blood pressure and metabolic alterations in fructose hypertensive rats, Pharmaceutical Biology, (2010), 48, p494-498.
[https://doi.org/10.3109/13880200903188526]

- Han, J, Hajjar, DP, Zhou, X, Gotto, AM Jr, Nicholson, AC, Regulation of peroxisome proliferator-activated receptorgamma- mediated gene expression. A new mechanism of action for high density lipoprotein, Journal of Biological Chemistry, (2002), 277, p23582-23586.
- Horowits, JR, Rivard, A, Van der zee, R, Hariawala, M, Sheriff, DD, Esakof, DD, Chaudhry, GM, Symes, JF, Isner, JM, Vascular endothelial growth factor/vascular permeability factor produces nitric oxide-dependent hypotension. Evidence for a maintenance role in quiescent adult endothelium, Arteriosclerosis. Thrombosis. and Vascular Biology, (1997), 17, p2793-2800.
-
Horton, D, Goldstein, JL, Brown, MS, SREPBs: Activators of the complete program of cholesterol and fatty acid synthesis in the liver, Journal of Clinical Investigation, (2002), 109, p1125-1131.
[https://doi.org/10.1172/jci15593]

-
Joyce, C, Freeman, L, Brewer, HB Jr, Santamarina-Fojo, S, Study of ABCA1 function in transgenic mice, Arteriosclerosis. Thrombosis. and Vascular Biology, (2003), 23, p965-971.
[https://doi.org/10.1161/01.atv.0000055194.85073.ff]

- Kim, BK, Shin, GK, Jeon, BS, Bae, DW, Cha, JY, Cholesterol-lowering effect of mushroom powder in hyperlipidemic rats, Journal of the Korean Society of Food Science and Nutrition, (2001), 30, p510-515.
-
Kim, GH, Seong, BJ, Kim, SI, Han, SH, Kim, HH, Lee, KS, Yield and quality characteristics of ginseng's first byproducts, Korean Journal of Medicinal Crop Science, (2011), 19, p313-318.
[https://doi.org/10.7783/kjmcs.2011.19.5.313]

- Krause, BR, Auerbach, BJ, Reverse cholesterol transport and future pharmacological approaches to the treatment of atherosclerosis, Current Opinion in Investigational Drugs, (2001), 2, p375-381.
- Kwak, H, Choi, GN, Park, JH, Kim, JH, Jeong, HR, Jeong, CH, Heo, HJ, Antioxidant and neuronal cell protective effect of purple sweet potato extract, Journal of Agriculture and Life Sciences, (2010), 44, p57-66.
-
Kwon, JW, Lee, HK, Park, HJ, Kwon, TO, Choi, HR, Song, JY, Screening of biological activities to different ethanol extracts of Rubus coreanus miq, Korean Journal of Medicinal Crop Science, (2011), 19, p325-333.
[https://doi.org/10.7783/kjmcs.2011.19.5.325]

- Lee, MK, Lee, HS, Choi, GP, Oh, DH, Kim, JD, Yu, CY, Lee, Y, Screening of biological activities of the extracts from Rubus coreanus miq, Korean Journal of Medicinal Crop Science, (2003), 11, p5-12.
- Lee, SY, Shin, YJ, Park, JH, Kim, SM, Par, CS, An analysis of the Gyungokgo's ingredients and a comparison study on anti-oxidation effects according to the kinds of extract, Korea Journal of Herbology, (2008), 23, p123-136.
-
Lim, S, Shin, H, Song, JH, Kwak, H, Kang, SM, Won Yoon, J, Choi. S.H., Cho SI, Park, KS, Lee, HK, Jang, HC, Koh, KK, Increasing prevalence of metabolic syndrome in Korea: The Korean National Health and Nutrition Examination Survey for 1998-2007, Diabetes Care, (2011), 34, p1323-1328.
[https://doi.org/10.2337/dc10-2109]

- Mahley, RW, Innerarity, TL, Rall, SCJr, Weisgrader, KH, Plasma lipoproteins: Apoprotein structure and function, Journal of Lipid Research, (1984), 25, p1277-1294.
- Mckenny, JM, Lipid management: tools for getting to the goal, American Journal of Managed Care, (2001), 7, p299-306.
- Miettinen, TA, Cholesterol absorption inhibition: A strategy for cholesterol-lowering therapy, AInternational Journal of Clinical Practice, (2001), 55, p710-716.
- Moon, SJ, Nutritional problems of Korean, Korean Journal of Nutrition, (1996), 29, p371-380.
-
Mosmann, T, Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays, Journal of Immunological Methods, (1983), 65, p55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Mullen, E, Brown, RM, Osborne, TF, Shay, NF, Soy isoflavones affect sterol regulatory element binding proteins (SREBPs) and SREBP-regulated genes in HepG2 cells, Journal of Nutrition, (2004), 134, p2942-2947.
[https://doi.org/10.1093/jn/134.11.2942]

- National Statistical Office, Death statistics in 2012. National Statistical Office( http://www.kostat.go.kr ), Daejeon, Korea, (2012).
-
Ngamukote, S, Mäkynen, K, Thilawech, T, Adisakwattana, S, Cholesterol-lowering activity of the major polyphenols in grape seed, Molecules, (2011), 17, p5054-5061.
[https://doi.org/10.3390/molecules16065054]

-
Pal, S, Ho, N, Santos, C, Dubois, P, Mamo, J, Croft, K, Allister, E, Red wine polyphenolics increase LDL receptor expression and activity and suppress the secretion of ApoB100 from human HepG2 cells, Journal of Nutrition, (2003), 133, p700-706.
[https://doi.org/10.1093/jn/133.3.700]

-
Sarr, M, Chataigneau, M, Martins, S, Schott, C, El Bedoui, J, Oak, MH, Muller, B, Chataigneau, T, Schini-Kerth, VB, Red wine polyphenols prevent angiotensin II-induced hypertension and endothelial dysfunction in rats: Role of NADPH oxidase, Cardiovascular Research, (2006), 71, p794-802.
[https://doi.org/10.1016/j.cardiores.2006.05.022]

- Seeram, NP, Adams, LS, Zhang, Y, Lee, R, Sand, D, Scheuller, HS, Heber, D, Blackberry, black raspberry, blueberry, cranberry, red raspberry and strawberry extracts inhibit growth and stimulated apoptosis of human cancer cellsin vitro, Journal of Agricultural and Food Chemistry, (2006), 54, p9329-9339.
- Shin, MK, Han, SH, Effects of methanol extracts frombamboo(Pseudosasa japonica Makino) leaves extracts on lipid metabolism in rats fed high fat and high cholesterol diet, Journal of the Korean Society of Food Culture, (2002), 17, p30-36.
-
Singh, DK, Banerjee, S, Porter, TD, Green and black tea extracts inhibit HMG-CoA reductase and activate AMP kinase to decrease cholesterol synthesis in hepatoma cells, Journal of Nutritional Biochemistry, (2009), 20, p816-822.
[https://doi.org/10.1016/j.jnutbio.2008.07.011]

- Singleton, VL, Rossi, Jr, Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, American Journal of Enology and Viticulture, (1965), 16, p144-158.
-
Steinberg, D, A docking receptor for HDL cholesterol esters, Science, (1996), 271, p460-461.
[https://doi.org/10.1126/science.271.5248.460]

- Taniguchi, T, Chen, J, Cooper, AD, Regulation of cholesterol 7 ?-hydroxylase gene expression in Hep-G2 cells, Journal of Biological Chemistry, (1994), 269, p10071-10078.
-
Thomsen, LL, Miles, DW, Happerfield, L, Bobrow, LG, Knowles, RG, Moncada, S, Nitric oxide synthase activity in human breast cancer, British Journal of Cancer, (1995), 72, p41-44.
[https://doi.org/10.1038/bjc.1995.274]

-
Tyroler, HA, Coronary heart disease epidemiology in the 21st century, Epidemiologic Reviews, (2000), 22, p7-13.
[https://doi.org/10.1093/oxfordjournals.epirev.a018026]

-
Uto-Kondo, H, Ayaori, M, Ogura, M, Nakaya, K, Ito, M, Suzuki, A, Takiguchi, S, Yakushiji, E, Terao, Y, Ozasa, H, Hisada, T, Sasaki, M, Ohsuzu, F, Ikewaki, K, Coffee consumption enhances high-density lipoprotein-mediated cholesterol efflux in macrophages, Circulation Research, (2010), 106, p779-787.
[https://doi.org/10.1161/circresaha.109.206615]

-
Wang, SY, Lin, HS, Antioxidant activity in fruits and leaves of blackberry, raspberry, and strawberry varies with cultivar and developmental stage, Journal of Agricultural and Food Chemistry, (2000), 48, p140-146.
[https://doi.org/10.1021/jf9908345]

- Xie, JT, Wu, JA, Lin, E, Wang, CZ, Yuan, CS, The composition and effects of ginseng leaf, Oriental Pharmacy and Experimental Medicine, (2004), 4, p1-8.
- Yotsumoto, H, Yanagita, T, Yamamoto, K, Ogawa, Y, Cha, JY, Mori, Y, Inhibitory effect of Oren-Gedoku-to and its components on cholesteryl ester synthesis in cultured human hepatocyte HepG2 cells: Evidence from the cultured HepG2 cells andin vitroassay of ACAT, Planta Medica, (1997), 63, p141-145.