가수분해 처리에 의한 홍삼과 인삼의 중성 Ginsenoside 함량 변화
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study was carried out to investigate change of ginsenoside contents in red and fresh ginseng according to root part and age by hydrolysis. Neutral total ginsenoside contents by hydrolysis in 6-year main root and lateral root were significantly increased than those by non-hydrolysis, as 41.6 and 32.8%, respectively. However, there was no significant difference in red ginseng. In fresh ginseng, ginsenoside contents of the protopanaxatriol group such as Re, Rf, Rg1, Rg2, and Rh1 were not significantly different, but Rb1, Rb2, Rb3, Rc, and Rd showed significant difference. The increase rate of neutral total ginsenoside content by hydrolysis was higher in epidermis-cortex than stele. Also, the neutral total ginsenoside content was fine root > rhizome > lateral root > main root, respectively. While there was no tendency towards the increase of ginsenoside by hydrolysis with the increase of root age in fine root and rhizome, there was significant decrease in main root and lateral root.
Keywords:
Panax ginseng, Ginsenoside, Epidermis-Cortex, Stele, Hydrolysis서 언
고려인삼으로부터 분리된 ginsenoside는 백삼 특유성분이 6 종, 홍삼 특유성분이 14종, 공통성분이 18종으로 총 38종의 ginsenoside가 밝혀져 있다 (Kim et al., 2013). 그 중 Malonyl-ginsenoside (M-G)는 수삼이나 백삼중에 존재 하는 주사포닌의 하나로 (Kitagawa et al., 1987), 기억 학습 능력 향상 (Abe et al., 1994), 항당뇨 (Liu et al., 2013) 등에 효 과가 있다.
M-G는 protopanaxadiol 계의 ginsenoside Rb1, Rb2, Rc 및 Rd의 3위 당쇄 말단 glucose 6번 수산기에 malonic acid의 carboxyl group이 ester 결합 한 산성 ginsenoside이다. 수삼에 서 M-G 함량은 총 ginsenoside 함량의 35 ~ 60% 수준으로 (Liu et al., 2012) 비교적 높은 함량을 차지한다. 그러나 MG 함량은 수삼의 건조 시간과 온도, 추출용매 농도에 따라 변 화하고 (Du et al., 2004), 수용성이 매우 강하며, 불안정하여 추출 및 분획조건에 따라 함량이 다르게 분석 된다 (Shin et al., 2001).
M-G를 알카리로 처리하거나, 2시간여 동안 증숙하면 malonyl group이 쉽게 제거되어 중성 ginsenoside로 전환된다 (Park, 1996; Kitagawa et al., 1987). MacCrehan와 White (2013)는 인삼 뇌두의 ginsenoside를 NH4OH와 KOH를 첨가 하여 추출한 결과 무처리에 비하여 ginsenoside 함량이 가열처 리와 같이 증가되었다.
이와 같이 M-G는 매우 불안정하여 표준물질로 사용하기가 어렵기 때문에 KOH로 가수분해하여 M-G 함량을 확인하는 간접적인 방법으로 진행되어 왔다 (Court et al., 1996a; Du et al., 2004; MacCrehan and White, 2013).
인삼은 재배환경 (Lee et al., 2011, 2012), 연근 (Han et al., 2013), 품종 (Kwon et al., 1991)에 따라 뿌리의 형태적 특성이 달라지고, ginsenoside 함량도 차이를 나타낸다 (Ahn et al., 2008). 또한, M-G 함량도 재배환경과 (Wills and Stuart, 2001), 연근 (Court et al., 1996b), 뿌리 직경 (Christensen et al., 2006)에 따라 다르다고 하였다.
따라서 본 연구는 인삼의 4, 5, 6년 근 부위별로 추출 한 후, 가수분해하여 ginsenoside 함량 변화를 조사하여 원료 및 가공 인삼의 평가기준, 인삼의 고사포닌 품종 선발기 준으로 활용하기 위하여 실시하였다.
재료 및 방법
1. 실험재료
수삼은 2007년부터 전북 고창 지역에서 직파재배 한 4, 5, 6년생을 2012년 가을에 수확한 것을 사용하였으며, 홍삼은 충 남 부여 지역에서 생산된 6년 근을 가공한 것을 구입하여 사 용하였다. 시료개체간의 차이를 줄이기 위해 수삼의 직경은 25 ~ 27㎜로 비슷한 개체를 선발하여 분석시료로 하였다. 홍 삼은 동체와 지근으로 나누었으며, 수삼은 연근별로 뇌두, 동 체, 지근, 세근으로 분리하였다. 중심주 (Stele)와 피층 (Epidermis-Cortex)은 개체별 동체의 직경이 일정한 부위를 약 0.8 ~ 1.2㎝ 두께로 자르고, Surgical Blade No. 11 (Feather Safety Razor Co, Japan)으로 구분하여 분리하였다.
분리된 시료는 freeze drier (Model FD-8512, Ilshin Lab Co., Ltd, Korea)에서 3일간 동결 건조하여 Wonder Blender (WB-1, SANPLATEC CORP. USA)로 40 mesh 크기로 분 말화한 후 ginsenoside 추출용 시료로 사용하였다.
2. Ginsenoside 분석
추출은 50% methanol을 사용하여 Li 등 (2010)의 방법으 로 실시하였다. 각 시료를 3반복으로 3 g 측량하여 50% methanol 60㎖를 250㎖의 삼각플라스크에 넣고 ultra-sonicater (60 khz, heat power 330 W; JAC Ultrasonica 4020, KODO, Korea)로 35 ± 5°C에서 1시간동안 각각 추출하 였다. 추출물을 냉각시켜 여과한 후 잔사에 50% methanol 60㎖을 넣고 앞의 방법으로 2회 반복 추출하였다.
SPE 전처리는 Sep-Pak C18 cartridge (Mega BE-C18, Agilent Technologies, USA)을 먼저 5㎖ MeOH로 서서히 용출시켜 1차 conditioning을 하고 다시 5㎖ dd-h2O로 2차 conditioning 시켰다. 추출 시료액 5㎖를 cartridge에 loading 하고 5㎖ dd-H2O로 서서히 용출하고 5㎖ 20% MeOH로 서서히 용출하여 제거하였다. 최종적으로 이 cartridge에 10㎖ 90% MeOH를 처리하여 서서히 ginsenoside 성분을 용출시켜 0.45㎛ polytetrafluoroethylene (PTFE) syringe filter (Waters, Milford, MA, USA)로 여과하여 수집하였다.
가수분해는 Court 등 (1996a)의 방법으로 실시하였다. SPE 전처리 후 얻어진 분석용 시료액 850㎕에 5% KOH 80㎕ 를 첨가한 후 실온 (26 ± 2°C)에서 방치하였다. 2시간 후 14% Kh2PO4를 80㎕ 처리한 후 0.45㎛ polytetrafluoroethylene (PTFE) syringe filter (Waters, Milford, MA, USA)로 여과하 여 UV Detector 가 부착된 HPLC (NS-4000, FUTECS Co., Korea)로 분석하였다.
Ginsenoside (Rb1, Rb2, Rb3, Rc, Rd, Re, Rf, Rg1, Rg2, Rg3, Rh1, Rh2) 표준물질은 Fleton Natural Products Co., Ltd (China)에서, water, acetonitrile, MeOH은 J. T. Baker (USA)에서 구입하여 사용하였다.
표준곡선 작성은 표준용액 12종의 ginsenoside 표준품을 각 각 1㎎으로 정확히 평량하여 10 mL MeOH로 용해시켜 1000 ppm 농도로 표준원액을 만들고, MeOH로 희석하여 83.33, 41.67, 20.83 및 10.416 ppm 농도가 되도록 만든 후 HPLC에 주입, 3회 반복하여 얻은 크로마토그램으로부터 농도 와 피크 면적의 계산값으로 표준곡선을 작성하였다. 정량곡선 에서 농도에 따른 회귀계수 (R)는 ginsenoside Rb1-0.9997, Rb2-0.9998, Rb3-0.9998, Rc-0.9997, Rd-0.9998, Re-0.9996, Rf-0.9997, Rg1-0.9996, Rg2-0.9997, Rg3-0.9997, Rh1-0.9998, Rh2-0.9999으로 모두 R값이 0.99 이상으로 1에 근접하여 정량 성이 양호하였다.
Column은 Bischoff C18 ace-ESP (Bischoff Co., Germany) 을 사용하였고, UV wavelength는 203㎚, flow rate는 1.0㎖/min, column temperature는 35°C에서 실시하였으며, HPLC 용리조건은 acetonitrile (%) : water (%) 가 20 : 80 (0 분), 20 : 80 (10분), 29 : 71 (39분), 41 : 59 (67분), 47 : 53 (70분), 71 : 29 (90분), 71 : 29 (95분), 20 : 80 (95분), 20 : 80 (115분)로 실시하였다 (Han et al., 2013).
Total ginsenoside 함량은 HPLC 법으로 정량된 ginsenoside Rb1, Rb2, Rb3, Rc, Rd, Re, Rf, Rg1, Rg2, Rg3, Rh1, Rh2 의 합으로 구하였다.
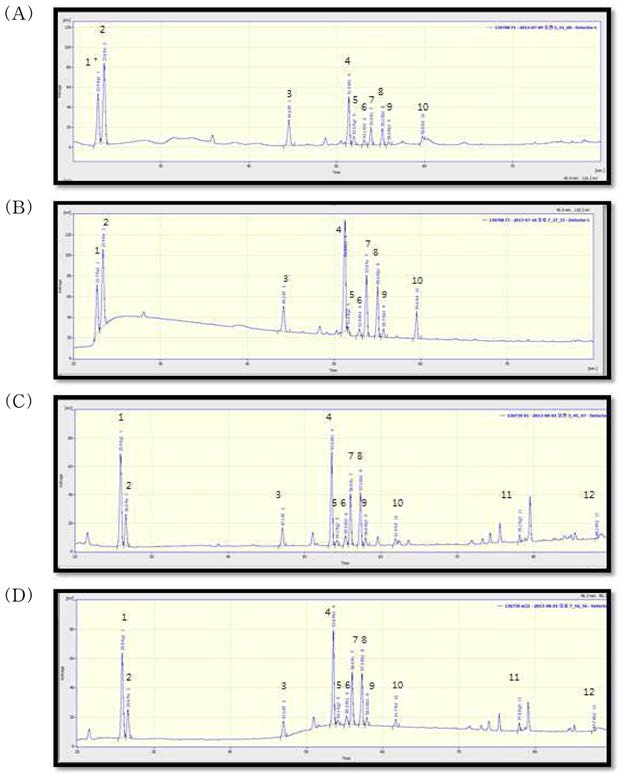
3. 수삼의 가수분해에 따른 ginsenoside 피크 재확인
수삼 분석 시료의 가수분해에 따른 ginsenoside 피크 재확인 은 Waters-PAD (Waters 1525, detector 2998, USA)를 활용하 여 Table 1과 같은 조건으로 분석하여 확인 하였다. Column 은 XbridgeTM C18 (Waters Co., USA)을 사용하였고, UV wavelength는 203㎚, flow rate는 1.0㎖/min, column temperature는 40°C에서 실시하였다.
4. 통계 분석
Ginsenoside 함량 분석 결과에 대한 Duncan’s Multiple Range Test (DMRT)는 SAS (v.9.3) 프로그램을 이용하였다.
결과 및 고찰
1. 가수분해에 의한 6년 근 수삼과 홍삼의 total ginsenoside 함량 비교
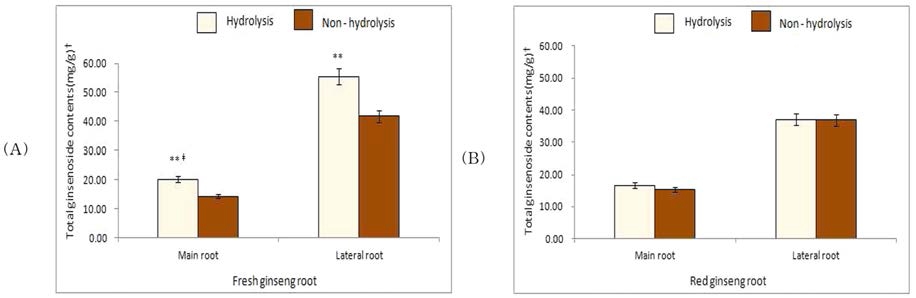
6년 근 수삼의 total ginsenoside 함량은 동체 14.27㎎/g, 지근 41.78㎎/g이었으나, 가수분해하여 M-G를 중성화시킨 결 과 동체 20.20 ㎎/g, 지근 55.48 ㎎/g으로 각각 41.6, 32.8% 증가하여 모두 가수분해 전후 유의적인 차이를 나타 내었다 (Fig. 1A).
6년 근 홍삼의 total ginsenoside 함량은 동체 15.28㎎/g, 지근 36.94㎎/g이었으나, 가수분해한 결과 동체 16.69㎎/g, 지근 37.14㎎/g으로 소량 증가하였으나 가수분해 전후 유의적 인 차이를 나타내지 않았다 (Fig. 1B).
이러한 결과는 수삼에서 M-G가 가수분해에 의하여 중성 ginsenoside로 전환되어 total ginsenoside 함량이 크게 증가하 였으나, 홍삼은 제조 과정 중 고온에 의한 증숙과 건조 과정 에서 대부분의 M-G가 중성 ginsenoside로 변화되어 가수분해 에 의한 total ginsenoisde 함량 변화는 거의 일어나지 않은 것으로 생각된다.
Liu 등 (2012)은 수삼과 홍삼의 ginsenoside 함량을 분석한 결과 M-G 함량은 홍삼에서 검출되지 않았으나, 수삼에서 12.94㎎/g으로 총 ginsenoside 함량의 45.3%를 차지하였는데, 본 실험에서 가수분해 처리에 의한 ginsenoside 증가량과 유사 하였다. 그러나, M-G 함량 외 PPD 계 ginsenoside 가 다른 고분자 물질과 결합되어 가수분해에 의한 total ginsenoside 함 량 변화에 영향을 미칠 것으로 판단되어지나, 이에 대한 연구 는 미흡한 실정으로 추후 지속적인 연구가 진행되어져야 할 것이다.
수삼에서 가수분해로 인한 개별 ginsenoside 성분의 변화는 panaxatriol계 ginsenoside (Re, Rf, Rg1, Rg2, Rh1) 함량은 거의 변화하지 않은 반면, M-G가 공존하는 panaxadiol계 ginsenoside (Rb1, Rb2, Rb3, Rc, Rd) (Kitagawa et al., 1989; Sun et al., 2011) 함량의 변화는 크게 나타나 가수분 해 전후 유의적인 차이가 있었으나 (Table 2, Fig. 2A, A), 홍삼에서는 개별 ginsenoside 성분의 변화가 거의 없어 가수분 해 전후 유의적인 차이가 없었다 (Table 3, Fig. 2C, D).
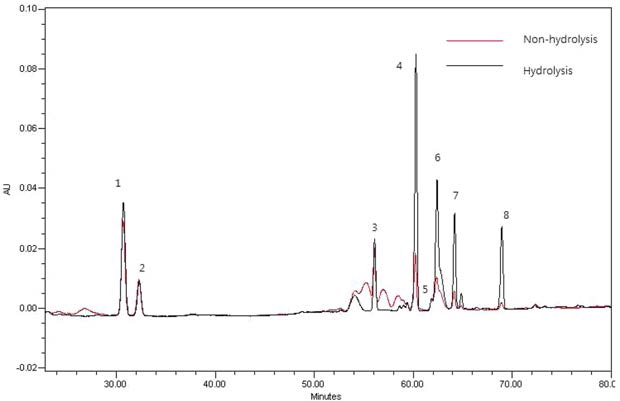
M-G류는 일반적인 이동상과 HPLC 분석조건에서는 분리가 어렵다 (Kim et al., 1982; Yamaguchi et al., 1988). Shin 등 (2001)은 상온 추출법으로 조사포닌을 알카리 처리한 다음 HPLC하여 처리 전과 비교한 결과 상온추출 사포닌에서는 MG Rb1, Rb2, Rc,로 추정되는 피크를 볼 수 있으나 알카리 처 리시 이들이 없어지고, ginsenoside Rb1, Rb2 및 Rc가 상대적 으로 증가하는 것으로 보아 M-G의 존재를 추정하였다. 하지 만 본 실험에서 M-G로 추정되는 피크가 분리되지 않아 HPLC 분석 조건을 달리하여 재분석을 실시하였다. 그 결과, 가수분해 전 M-G로 추정되는 피크들을 확인할 수 있었나, 알 카리 가수분해 처리 후 사라지고, PPD계 ginsenoside 함량은 상대적으로 증가하는 것을 확인할 수 있었다 (Fig. 3).
수삼에서 가수분해 전 ginsenoside Rb1, Rb2, Rb3, Rc, Rd 함량은 홍삼보다 작았지만 가수분해 처리에 의한 함량은 수삼 이 홍삼보다 많거나 비슷하였고, ginsenoside Re, Rg1은 가수 분해 전후 상관없이 수삼에서 많았다. 이러한 결과는 홍삼을 증숙하는 과정에서 ginsenoside Rb1, Rb2, Rb3, Rc, Rd 함량 이 증가하다가 일부 Rg3로 전환하였으며 (Smukawa et al., 1995), Re, Rg1 은 열에 의해 가수분해 되었기 때문으로 생각 된다 (Nam et al., 2012).
홍삼 제조 과정에서 열에너지를 받아 홍삼이 원료삼의 total ginsenoside 함량보다 증가하여 (Ha and Ryu, 2005), 대부분 의 total ginsenoside 함량은 백삼보다 홍삼에서 높다고 하였다 (Nam, 2005; Kim et al., 2013). 따라서 인삼류 제품의 품질 관리를 위한 ginsenoside 함량 측정은 M-G 함량을 중성 ginsenoside로 변환시켜 총 중성 ginsenoside 함량을 분석해야 할 것으로 판단된다.
2. 가수분해에 의한 4, 5, 6년 근의 조직별 ginsenoside 함 량 비교
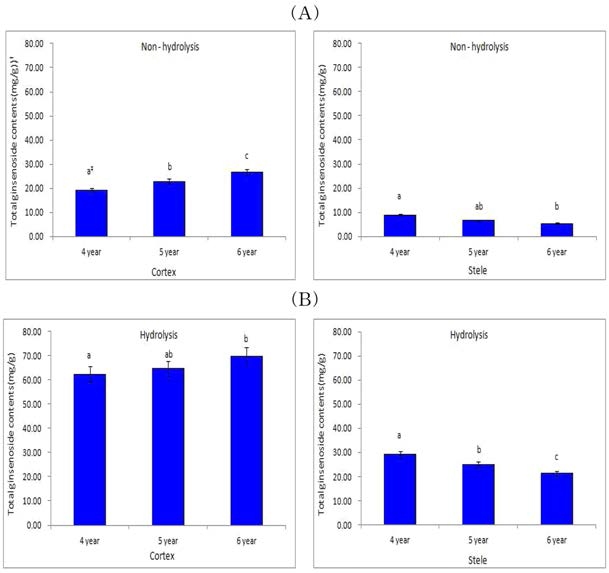
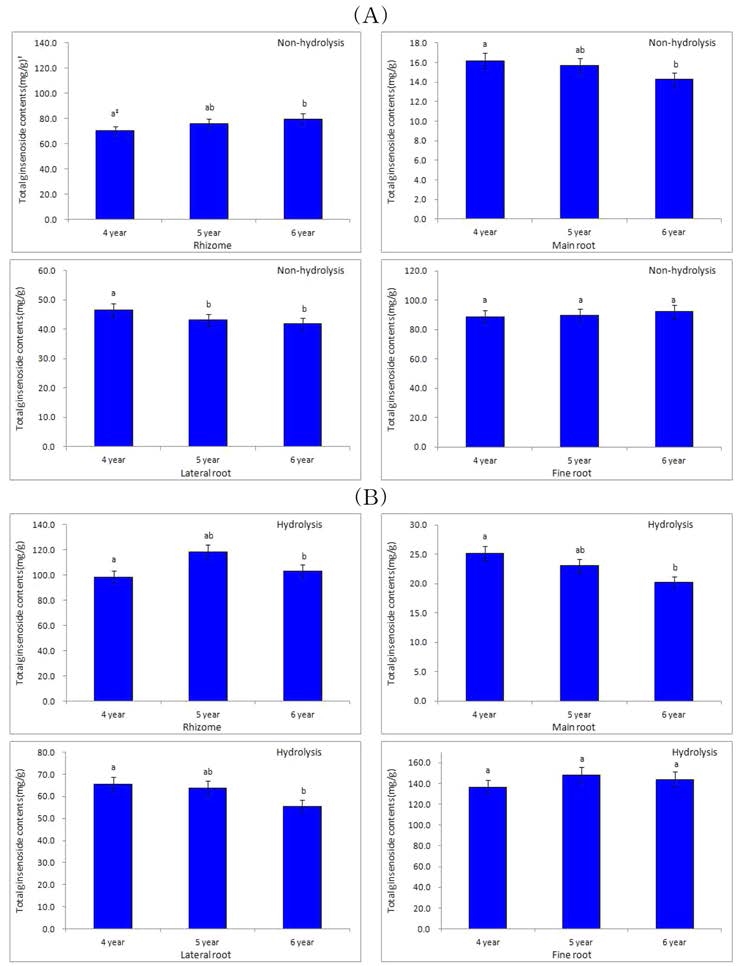
4, 5, 6년 근 동체의 피층 total ginsenoside 함량은 각각 21.31, 25.06, 29.06㎎/g, 중심주 8.61, 6.77, 5.93㎎/g이었다 (Fig. 4A). 추출액을 가수분해 처리한 결과 total ginsenoside 함량은 피층 62.38, 64.61, 69.84㎎/g, 중심주 18.80, 14.84, 13.81 ㎎/g으로 크게 증가 하였고, 연근이 증가할수록 피층 의 ginsenoside 함량은 증가한 반면 중심주는 감소하였다 (Fig. 4B).
가수분해에 의한 ginsenoside 함량의 증가 폭은 4, 5, 6년 근 피층에서 각각 65.8, 61.2, 58.4%, 중심주에서 각각 54.2, 54.4, 57.1%로 중심주 보다 피층의 변화가 더 컸으며, 연근별 로는 저년근은 피층, 고년근은 중심주에서 함량의 변화가 크게 나타났으며 피층, 중심주에서 모두 유의적인 차이를 나타냈다.
이러한 결과에서 M-G 함량은 중심주보다 피층에 많이 분 포하는 것을 의미한다. Christensen 등 (2006)은 5년 근 미국 삼의 근 직경에 따라 M-G 함량을 분석한 결과 근 직경이 커 질수록 M-G 함량은 감소한다고 하였다. 이는 근직경이 커질 수록 피층의 비율보다 중심주의 비율이 더 크게 증가한 연구 결과와 관련이 있을 것으로 생각된다 (Park et al., 1988).
3. 가수분해에 의한 4, 5, 6년 근의 부위별 ginsenoside 함 량 비교
4, 5, 6년 근 부위별 total ginsenoside 함량은 각각 뇌두 70.30, 75.73, 79.78㎎/g, 동체 16.20, 15.67, 14.27㎎/g, 지 근 46.48, 43.07, 41.78㎎/g, 세근 88.47, 89.59, 92.15㎎/g 으로 연근이 높을수록 동체, 지근의 함량은 유의적으로 감소 하였고, 뇌두와 세근의 함량은 증가하였으나 유의성을 보이지 않았다 (Fig. 5A). 이러한 결과는 Han 등 (2013)의 결과와 일치하였으나 함량에서는 다소 차이를 나타낸 것은 ginsenoside 함량은 대부분 피층에 분포하는데 (Kubo et al., 1980; Tani et al., 1981) 분석 인삼 개체 직경에 따른 피층의 비율이 달 랐기 때문으로 생각된다.
가수분해 처리에 의한 4, 5, 6년 근 부위별 total ginsenoside 함량은 각각 뇌두 98.56, 108.18, 103.05㎎/g, 동체 25.13, 23.02, 20.20㎎/g, 지근 65.48, 61.67, 55.48㎎/g, 세근 136.46, 148.09, 143.81㎎/g으로 크게 증가하였다 (Fig. 5B). 연근이 높을수록 동체, 지근의 함량은 유의적으로 감소한 반 면, 뇌두와 세근은 일정한 경향이 없었고 유의성도 보이지 않 았다.
4, 5, 6년 근 가수분해에 의한 뿌리 부위별 ginsenoside 함 량의 증가 비율은 각각 뇌두 28.7, 30.0, 22.6%, 동체 35.5, 31.9, 29.4%, 지근 29.0, 30.2, 24.7%, 세근 35.2, 39.5, 35.9% 으로 평균 31.0%의 증가폭을 나타내었고, 증가량은 세 근에서 각각 47.99, 58.50, 51.66㎎/g 으로 가장 많았다.
가수분해에 의한 ginsenoside 함량 증가는 피층 부위에서 더 높게 나타났으며, 뿌리 부위별 증가는 세근 >뇌두 >지근 > 동 체 순으로 나타났다.
이상의 결과에서 수삼의 M-G 함량은 total ginsenoside 함 량의 30% 이상이므로 고사포닌 함량 계통 육성을 위해서는 M-G 함량을 포함하여 비교하여야 할 것으로 판단된다. 또한, 수삼, 백삼, 태극삼의 품질 기준에서도 ginsenoside 함량은 MG를 가수분해 처리하여 total ginsenoside 함량을 비교하는 것 이 타당할 것으로 판단된다.
REFERENCES
-
Abe, K, Cho, SI, Kitagawa, I, Nishiyama, N, Saito, H, Differential effects of ginsenoside Rb1 and malonylginsenoside Rb1 on long-term potentiation in the dentate gyrus of rats, Journal of Brain Research, (1994), 649, p7-11.
[https://doi.org/10.1016/0006-8993(94)91042-1]

- Ahn, IO, Lee, SS, Lee, JH, Lee, MJ, Jo, BG, Comparison of ginsenoside contents and pattern similarity between root parts of new cultivars inPanax ginsengC. A. Meyer, Journal of Ginseng Research, (2008), 32, p15-18.
-
Christensen, LP, Jensen, M, Kidmose, U, Simultaneous determination of ginsenosides and polyacetylenes in American ginseng root(Panax quinquefoliumL.) by high-performance
liquid chromatography, Journal of Agricultural and Food Chemistry, (2006), 54, p8995-9003.
[https://doi.org/10.1021/jf062068p]

- Court, WA, Hendel, JG, Elmi, J, Reversed-phase high-performance liquid chromatographic determination of ginsenosides ofPanax quinquefolium, Journal of Chromatography A, (1996a), 755, p11-17.
-
Court, WA, Reynolds, LB, Hendel, JG, Influence of root age on the concentration of ginsenoside of American ginseng(Panax quinquefolium), Canadian Journal of Plant Science, (996b), 76, p853-855.
[https://doi.org/10.4141/cjps96-144]

-
Du, XW, Wills, RBH, Stuart, Dl, Changes in neutral and malonyl ginsenosides in American ginseng(Panax quinquefolium) during drying, storage and ethanoic extraction, Journal of Food Chemistry, (2004), 86, p155-159.
[https://doi.org/10.1016/j.foodchem.2003.11.003]

- Ha, DC, Ryu, KH, Chemical components of red, white and extruded root ginseng, Journal of Food Science and Nutrition, (2005), 34, p247-254.
-
Han, JS, Tak, HS, Lee, KS, Kim, JS, Choi, JE, Comparison of ginsenoside content according to age and diameter inPanax ginsengC. A. Meyer cultivated by direct seeding, Korean Journal of Medicinal Crop Science, (2013), 21, p184-190.
[https://doi.org/10.7783/kjmcs.2013.21.3.184]

-
Kubo, M, Tani, T, Katsuki, K, Ishzaki, S, Arichi, S, Histochemistry. I. Ginsenosides in ginseng(Panax ginsengC. A. Meyer, root), Journal of Natural Products, (1980), 43, p278-284.
[https://doi.org/10.1021/np50008a006]

-
Kim, HJ, Kwak, IA, Kim, HJ, Ahn, JS, Son, YB, A study on the amendment scheme of ginsenoside content standard regulation for red ginseng products in Korea, Journal of Food Hygiene and Safety, (2013), 28, p24-30.
[https://doi.org/10.13103/jfhs.2013.28.1.024]

- Kim, MW, Lee, JS, Choi, KJ, Comparative studies on the chemical components in ginseng. I. The ginsenosides and the free sugars content of various ginseng plants, Korean Journal of Ginseng Science, (1982), 6, p138-142.
- Kitagawa, I, Taniyama, T, Shibuya, H, Nota, T, Yoshikawa, M, Chemical studies on crude drug processing. V. On the constituents of ginseng radix rubra (2); Comparison of the constituents of white ginseng and red ginseng prepared from the samePanax ginsengroot, Yakugaku Zasshi, (1987), 107, p495-505.
- Kitagawa, I, Taniyama, T, Yoshikawa, M, Ikenishi, Y, Nakagawa, Y, Chemical studies on crude drug processing. VI. Chemical structures of malonyl-ginsenoside Rb1, Rb2, Rc and Rd isolated from the root ofPanax ginsengC. A. Meyer, Journal of Chemical and Pharmaceutical Bulletin, (1989), 37, p2961-2970.
- Kwon, WS, Chung, CM, Kim, YT, Choi, KT, Comparisons of growth, crude saponin, ginsenosides and anthocyanins in superior lines ofPanax ginsengC. A. Meyer, Korean Journal of Breeding Science, (1991), 23, p219-228.
-
Lee, SW, Kim, GS, Hyun, DY, Kim, YB, Kim, JW, Kang, SW, Cha, SW, Comparison of growth characteristics and ginsenoside content of ginseng(Panax ginsengC. A. Meyer) cultivated with greenhouse and traditional shade facility, Korean Journal of Medicinal Crop Science, (2011), 19, p157-161.
[https://doi.org/10.7783/kjmcs.2011.19.3.157]

- Lee, SW, Park, JM, Kim, SG, Park, KC, Jang, IB, Lee, SH, Kang, SW, Cha, SW, Comparison of growth characteristics and ginsenoside content of 6-year-old ginseng(Panx ginsengC. A. Meyer) by drainage class in paddy field, Korean Journal of Medicinal Crop Science, (2012), 20, p177-183.
- Li, X, Kang, SJ, Han, JS, Kim, JS, Choi, JE, Comparison of growth increment and ginsenoside content in different parts of ginseng cultivated by direct seeding and transplanting, Korean Journal of Medicinal Crop Science, (2010), 18, p70-73.
- Liu, Z, Li, Y, Li, X, Ruan, CC, Wang, LJ, Sun, GZ, The effects of dynamic changes of malonyl ginsenosides on evaluation and quality control ofPanax ginsengC. A. Meyer, Journal of Pharmaceutical and Biomedical Analysis, (2012), 64, p56-63.
-
Liu, Z, Li, W, Li, X, Zhang, M, Chen, L, Zheng, YN, Sun, GZ, Ruan, CC, Antidiabetic effects of malonyl ginsenosides fromPanax ginsengon type 2 diabetic rats induced by high-fat diet and streptozotocin, Journal of Ethnopharmacology, (2013), 145, p233-240.
[https://doi.org/10.1016/j.jep.2012.10.058]

- MacCrehan, WA, White, CM, Simplified ultrasonicallyand microwave-assisted solvent extractions for the determination of ginsenosides in powderedPanax ginsengrhizomes using liquid chromatography with UV absorbance or electrospray mass spectrometric detection, Analytical and Bioanalytical Chemistry, (2013), 405, p4511-4522.
- Nam, KY, comparative understanding between red ginseng and white ginsengs, processed ginsengs(Panax ginsengC. A. Meyer), Journal of Ginseng Research, (2005), 29, p1-18.
-
Nam, KY, Lee, NR, Moon, BD, Song, GY, Shin, HS, Choi, JE, Changes of ginsenosides and color from black ginseng prepared by steaming-drying cycles, Korean Journal of Medicinal Crop Science, (2012), 20, p27-35.
[https://doi.org/10.7783/kjmcs.2012.20.1.027]

- Park, H, Lee, MK, Cho, BG, Shape and compound relationship in ginseng quality, (1988), Proceedings of the 5th International Ginseng Symposium, Seoul, Korea, p133-138.
- Park, JD, Recent studies on the chemical constituents of Korean ginseng(Panax ginsengC. A. Meyer), Korean Journal of Ginseng Science, (1996), 20, p389-415.
-
Samukawa, K, Yamashita, H, Matsuda, H, Kubo, M, Simultaneous analysis of ginsenosides of various ginseng radix by HPLC, Yakugaku Zasshi, (1995), 115, p241-249.
[https://doi.org/10.1248/yakushi1947.115.3_241]

- Shin, JY, Choi, EH, Wee, JJ, The difference of ginsenoside compositions according to the conditions of extraction and fractionation of crude ginseng saponins, Journal of Food Science Technology, (2001), 33, p282-287.
- Sun, J, Mi, J, Qin, Q, Yu, Q, Wu, W, Liu, S, Identification of ginsenosides Rc, Rb2, Rb3 and related malonyl-ginsenosides inPanax ginsengextracts by using RRLC-Q-TOF-MS/MS, (2011), 2011 International Conference on Human Health and Biomedical Engineering, p1140-1143.
-
Tani, T, Kubo, M, Katsuki, T, Higashino, M, Hayashi, T, Arichi, S, Histochemistry. II. Ginsenosides in ginseng(Panax ginseng, Root), Journal of Natural Products, (1981), 44, p401-407.
[https://doi.org/10.1021/np50016a002]

- Wills, RBH, Stuart, DL, Production of high Quality Australian ginseng, Journal of Rural Industries Research and Development Corporation. Publicaion No. 01/170. Project No.UNC-8A, (2001).
- Yamaguchi, H, Matsuura, H, Kasai, R, Tanaka, O, Satake, M, Kohda, H, Izumi, H, Nuno, M, Katsuki, S, Isoda, S, Shoji, J, Goto, K, Analysis of saponins of wildPanax ginseng, Journal of Chemical and Pharmaceutical Bulletin, (1988), 36, p4177-4181.