더덕 잎, 줄기, 뿌리 부위의 Triterpenoid 사포닌 함량
© The Korean Society of Medicinal Crop Science
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0 ) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Codonopsis lanceolata (Campanulaceae) has been used in traditional medicines, as its roots contain several kinds of 3,28-bidesmosidic triterpenoid saponin with high medicinal values. In this study, we induced hairy root-derived transgenic plants of C. lanceolata and analyzed triterpenoid saponins from the leaf, stem and root. Transgenic plants were regenerated from the hairy roots via somatic embryogenesis. The saponins are lancemaside A, B and E, foetidissimoside A, and aster saponin Hb. Transgenic plants contained richer triterpenoids saponin than wild-type plants. Major saponin lancemaside A was the most abundant saponin in the stem from transgenic-plant, 4.76 ㎎·1−1 dry stem. These results suggest thattransgenic plants of C. lanceolata could be used as medicinal materials for the production of triterpene saponins.
Keywords:
Codonopsis lanceolata, Triterpenoid Saponin, Lancemaside A, B, E, Foetidissimoside A, Aster Saponin Hb서 언
더덕 (Codonopsis lanceolata Trautv.)은 한국을 포함한 중 국, 일본에 주로 자생하며 고도가 낮은 산이나 언덕 등에 분 포한다. 더덕의 뿌리는 주로 생체를 이용하거나 요리되어 음 식으로 이용되며, 예로부터 민간에서 천연약제로 사용되어져 왔다 (Ichikawa et al., 2009). 또한 더덕은 다른 임산물과 비 교하여 단기간 고소득을 얻을 수 있는 작물이며, 채산성이 다 른 산채와 비교하여 높다. 한국과 중국 등에서 전통적으로 더 덕의 뿌리는 진해제, 거담제, 해독제로 사용해왔다 (Ichikawa et al., 2009). 최근에는 더덕의 추출물을 이용한 여러 임상실 험결과들이 보고되면서 더덕 뿌리의 약리학적 효능이 새롭게 각인되고 있다. 더덕 추출물의 미백을 증진하고 (Kim et al., 2013), 항산화 증진에 관여 한다고 보고되었다 (Song et al., 2012). 특히 한국산 (강원도 횡성) 더덕의 뿌리 추출물을 투여 한 쥐에서 심리적 스트레스에 의하여 감소되는 것으로 알려진 남성호르몬 testosterone 농도가 감소되지 않는다는 것이 밝혀 졌고, 이것은 testosterone 이외의 다른 남성호르몬에도 영향을 미치는 것으로 보고되었다 (Sekita et al., 2005). Ushijima 등 (2007)은 더덕 뿌리추출물이 포함된 영양보조제가 남성 갱년 기 증후군 (PADAM-like symptoms)의 주요 원인이 되는 호 르몬인 androgen의 부분적인 결핍을 개선한다고 하였다. 또한 고칼로리, 고식이에 의해 유도된 비만쥐에 더덕뿌리를 먹인 결 과 체내 지질의 축적이 억제되어 항비만 혹은 비만 치료를 위 한 치료제로서의 잠재적 효과를 보여주었다 (Choi et al., 2013). Ichikawa 등 (2009)은 한국산 더덕 뿌리에서 7종류의 3, 28-bidesmosidic triterpenoid 사포닌을 분리하였고, 이 사포 닌은 lancemaside A, lancemaside B, lancemaside C, lancemaside E, lancemaside G, foetidissimoside A, aster saponin Hb로 각각 명명되었다. 더덕의 대표적인 triterpenoid 사포닌 중 주사포닌으로 알려진 lancemaside A는 대장염을 유 도한 쥐에서 염증인자 단백질 (NF-κB)을 억제하여 대장염을 완화시킨다고 보고하였다 (Joh et al., 2009). 또한 더덕 뿌리 에서 추출한 lancemaside A를 10㎎/㎏ 동물에 경구투약한 결과 scopolamine에 의해 유도된 기억력과 학습결핍 증상 이 개선되었다고 보고하였고 (Jung et al., 2012), 12-Otetradecanoylphorbol- 13-acetate로 유도된 피부염과 같은 염증 을 개선할 수 있다는 결과가 보고되었다 (Joh et al., 2014). 따라서 더덕 뿌리추출물은 다양한 형태의 건강식품으로써의 가능성뿐만 아니라 추출물의 분리, 정제를 통하여 의약품 개 발도 가능할 것으로 기대되고 있다. 따라서 건강식품이나 의 약품의 원료로 사용되기 위해서는 계속적인 많은 공급량이 필 요하나, 공급의 양이 증가되기 위해서는 많은 토지가 필요로 되며, 더덕 수확시기까지 34년의 시간이 걸린다. 따라서 이러 한 특징이 더덕생산 및 추출물을 대량 확보하기위한 걸림돌이 되고 있다.
본 연구에서는 자연산더덕을 기내로 들여와 생육시킨 더덕 과 유용물질 생산량 증대에 효과적인 rol 유전자를 삽입한 더덕 식물체의 잎, 줄기, 뿌리의 부위에 따른 triterpenoid saponin인 lancemaside A, lancemaside B, lancemaside E, foetidissimoside A 그리고 aster saponin Hb의 함량을 LCMS를 사용하여 비교분석 하였으며, 이를 바탕으로 더덕사포 닌을 건강식품 및 의약품으로 개발할 수 있는 기초기반을 마 련하기 위해 이 연구를 수행하였다.
재료 및 방법
1. 식물재료
식물재료는 강원대학교 연습림에서 채취한 자연산더덕을 기 내로 들여와 배양실에서 생육하고 있는 더덕식물체를 사용하 였다. 재료로 사용하기 4주전 계대배양을 실시하여 1일 16시 간 조명 (40 µmol m−2·s−1 백색 형광등), 25 ± 2°C로 조절되 는 배양실에서 생육시키며 재료의 상태가 신선한 것을 재료로 사용하였다.
2. 사포닌 분석을 위한 형질전환 더덕 식물체 유도
모상근 유도를 위해 절간 절편을 재료로 사용하였고 Agrobacterium rhizogenes은 R1000을 사용하였다. 절간절편은 0.5cm의 길이로 조제하고, A. rhizogenes은 Luria-Bertani medium broth (10 g/L bacto-tryptone, 5 g/L bacto-yeast extract, 10 g/L NaCl)로 배지를 조제하여 접종하였고, 진탕 배 양기에서 28°C, 48시간 동안 220 rpm으로 배양 하여 절간 절 편에 접종하였다. 접종 배지는 2% sucrose와 0.3% gelrite가 첨가된 호르몬 무처리 MS (Murashige and Skoog, 1962)배 지를 사용하였고, 1일 16시간 조명 (40 µmol m−2·s−1 백 색 형광등), 25 ± 2°C로 조절되는 암조건 배양실에서 모상근 을 유도하였다. 유도된 모상근 중 증식율이 가장 좋은 2개 라 인 (T1과 T2 라인)을 재료로 사용하였다. T1과 T2 라인 모 상근은 1㎝의 크기로 잘라 1.0㎎·l−1 2,4-D와 3% sucrose 에 0.3% gelrite가 첨가된 고체 MS배지에 접종하여 체세포 배발생 캘러스를 유도한 후, 1/2 MS배지에, 3% sucrose, 0.3% gelrite, 2.0㎎·l−1 thidiazuron (TDZ)과 1.0㎎·l−1 na phthaleneacetic acid (NAA)가 첨가된 배지로 옮겨 체세포배를 유도하였다. 유도된 체세포배는 발아를 위해 2% sucrose, 0.3% gelrite가 첨가된 1/2 MS배지에, 1.0㎎·l−1 abscisic acid (ABA)가 첨가된 배지로 옮겨 식물체를 유도 후, 1/2 MS배지에 2% sucrose, 0.3% gelrite 고체배지에서 증식 하 였다. 일반 식물체와 T1과 T2 모상근유래 식물체는 기내배양 5주 후, 순화를 위해 인공토양 (peatmoss : vermiculrite = 1 : 1) 에 이식하고 토양으로 이식한 시기는 4월 중순이며, 2개월 동 안 생육시킨 식물체는 triterpenoid 사포닌의 분석을 위한 재료 로 사용하였다.
3. 시료준비
사포닌 분석을 위한 더덕 일반식물체와 모상근 유래 각 식 물체의 잎, 줄기, 뿌리시료는 60°C 건조기에서 48시간 건조하 고 유발에 넣어 유봉으로 분쇄 후, 0.1 g씩 정량하여 300㎛ sieve를 통과한 시료를 사포닌 분석에 이용하였다. 사포닌 추 출을 위하여 각 분석 시료에 100% MeOH 10㎖을 넣은 후, 80°C 수조에서 40분간 초음파분해를 실시하였다. SEP전처리 방법은 Sep-Pak C18 (Waters, USA) cartridge에 10㎖의 80% MeOH를 천천히 용출 시켜 전처리 후, 추출 시료액 5㎖을 로딩한 후 100% MeOH 10㎖을 처리하여 천천히 사 포닌을 용출하였다. 추출된 시료는 rotary evaporator (Eyela N1000-S, Japan)로 농축하였고, 농축된 시료는 20% acetonitrile을 이용하여 회수하였다. 회수된 시료는 0.45㎛ membrane filter (Waters, USA)로 여과하여 LC-MSMS 분 석을 실시하였다.
4. LC-MS분석
Triterpenoid 사포닌은 lancemaside A, lancemaside B, lancemaside E, foetidissimoside A, aster saponin Hb로 가장 함량이 많은 순서의 5가지 사포닌을 분석하였다 (Ichikawa et al., 2009). 분석을 위한 5가지 더덕사포닌 standard의 분리는 TLC를 사용하여 분리하였다. TLC분석은 Merck 60F254 silica plate (Darmsadt, Germany)에 1000 ppm 더덕 뿌리추출액 10㎕을 점적하여 n-butanol : ethylacetate : water (6 : 3 : 1, v : v : v)의 혼합용액으로 전개하였다. 전개된 사포닌은 10% sulfuric acid용액을 분사하여 110°C 핫플레이트에 10분간 놓아 둔 후, 육안 및 254㎚ UV하에서 전개를 확인하였다. 각각의 사포닌이 전개된 silica plate의 silica powder를 회수하여 100% chloroform에 용출시킨 후, 상온의 rotary evaporator로 농축하여 농축된 시료는 80% MeOH로 회수하여 이전 보 고된 조건 (Ichikawa et al., 2009)으로 확인 후 분석을 위한 standard로 사용하였다. 사포닌 분석을 위한 Liquid chromatography-mass spectrometry 분석은 LC/MSMS (TSQ Quantum Ultra, Thermo Scientific, USA)로 수행 하였다. LC분석을 위한 column은 YMC-Pack Pro C18 RS (150 × 2.0㎜ I.D., 5㎛)를 사용하였다. 이동상은 H2O (0.1% formic acid): acetonitrile (73 : 27, v/v)을 사용하였고, 유속은 0.2 ㎖/min으로 설정하여 사용하였다. Column의 온도는 40°C 를 유지하며, 시료는 각 20㎕씩 주입하였다. Massspectrometer는 negative ion과 SIM (selected-ion monitoring) 하에서 작동하였다. ESI 는 4.5 kV의 spray voltage로 수행하 였다. Capillary voltage와 tube lens offset은 각각 −40 과 −208로 각각 고정하였다. Capillary temperature는 350°C로 고정하였다. Auxiliary gas로 사용된 nitrogen은 30psi로 유지하였다. 분석 시간은 두 부분으로 나누었으며, lancemaside B와 lancemaside E는 RT 03.3min에 m/z 1,351, foetidissimoside A, aster saponin Hb와 lancemaside A는 RT 3.35min에 m/z 1,189, 1,057 그리고 925로 분 석하었다. Isolation width는 1.5 m/z로 맞추었다.
표준시료는 lancemaside A, lancemaside B, lancemaside E, foetidissimoside A, aster saponin Hb를 각각 MeOH에 녹여 1000 ppm을 준비 후, 최종농도를 100, 500, 1000 ppm 농도로 희석하여 준비하였다. 샘플 및 표준용액은 5반복하여 각 20㎕를 주입하여 분석을 실시하였고, 회수율은 93-107% 로 관찰되었다. 정량곡선 및 방법은 Ichikawa 등 (2009)의 방 법을 따랐으며, 통계처리를 위하여 각각의 시료는 5반복하여 정량하였다.
5. 통계처리
모든 측정값은 5반복하여 측정한 평균값과 표준편차 (mean ± SD)로 표시하였고, 통게학적 분석은 SAS (SAS Inc., USA)를 이용하여 Duncan’s Multiple Range Test (DMRT)로 유의성 검정을 하였다.
결과 및 고찰
1. 사포닌 분석을 위한 형질전환 더덕 식물체유도
모상근 (Fig. 1A) 유래 체세포배 유도를 위해 2.0 ㎎/L 2,4-D가 첨가된 MS 배지에서 2개월간 체세포배발생 캘러스 를 유도하였다 (Fig. 1B). 절편 접종 2개월 후, 2개 라인의 모상근 유래 절편에서 진한 노란색의 체세포 배발생 캘러스가 형성되었으며, 체세포배 형성을 위해 비타민이 포함된 MS 기 본배지에 싸이토키닌인 2.0㎎/L TDZ와 옥신인 2.0㎎/L NAA를 혼합처리한 배지에서 체세포배가 형성되었다 (Fig. 1B). 모상근 절편유래 체세포 배발생캘러스 유도율은 T1라인 41.4% 그리고 T2라인 13.6%로 나타났으며, 체세포배 유도율 은 T1라인 30.8%, T2라인 8.4%로 라인 간 차이를 보였다 (Table 1). 체세포배 발아율은 T1라인 95% 그리고 T2라인 92%로 발아율은 큰 차이를 보이지 않았다 (Table 1). 유도된 체세포배는 1/2MS 호르몬 무처리 배지로 계대배양하여 기내 유식물체를 유도하였으며 (Fig. 1C), 유도된 기내 식물체는 78㎝ 길이로 생육 시킨 후 토양 순화하였다. 기내 일반 식물 체와 모상근 유래 더덕 식물체는 토양 이식 및 순화 2개월 후, 더덕 사포닌 분석을 위한 재료로 사용하였다 (Fig. 1D). 이전 더덕 체세포배 유도에 관한 연구에서는 종자유래 어린유 모의 자엽절편에서 80%의 체세포배를 유도하였고 (Min et al., 1992), 더덕형질전환 식물체 생산을 위한 체세포배유도에 서는 잎과 줄기절편에서 체세포배가 유도되었으나, 이전 연구 에서 유도하였던 (Kim et al., 2012) 뿌리절편에서는 체세포배 가 형성되지 않았다고 보고하였다 (Cho et al., 1999). 본 연 구에서는 일반부정근 절편에서는 체세포배가 유도되지 않았으 며, rol 유전자가 삽입된 더덕의 모상근 절편에서만 체세포배 가 유도되었다. 이전 연구에서 rolC 유전자를 삽입한 인삼뿌 리 유래 캘러스에서 체세포배가 유도되었고, 이러한 것은 rolC 유전자가 체세포배발생 경로에 관여한다고 언급하였으며, 이 것은 식물체 유래 유전자가 아닌 미생물유래 유전자의 단독 유전자가 식물에서 체세포배발생 과정에 관여한다는 것을 처 음으로 보고하였다 (Gorpenchenko et al., 2006). 따라서 T1, T2 라인을 절편으로 사용하여 유도된 체세포배 또한 모상근 유도 시 삽입된 rolC 유전자의 영향으로 뿌리에서 체세포배가 형성된 것으로 사료된다.
2. Triterpenoid 사포닌 분석
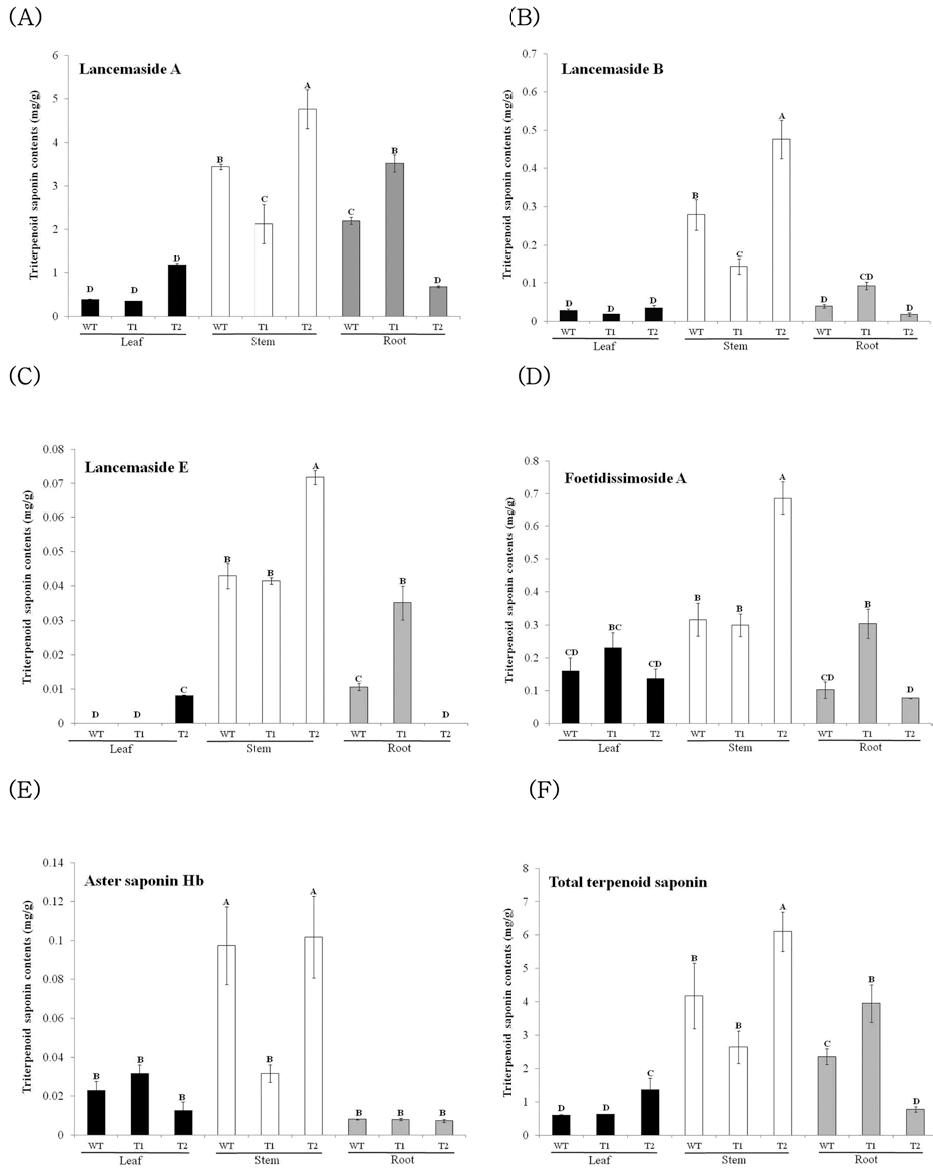
온실토양에서 5주간 생육한 T1 그리고 T2, 2개 라인 모상 근 유래 형질전환 식물체와 기내식물체를 순화한 일반더덕 식 물체의 잎, 줄기, 뿌리 절편의 triterpenoid 사포닌 함량을 비 교분석 하였다. 더덕 사포닌 가운데 대표적인 사포닌으로 알려진 주사포닌 인 lancemaside A와 lancemaside B, lancemaside E, foetidissimoside A, aster saponin Hb를 분석 하였다 (Ichikawa et al., 2009). 분석결과 형질전환 식물체와 일반 식물체 간 그리고 부위에 따라 5가지 사포닌 함량의 차 이가 확인됐다. 형질전환 더덕 T2의 줄기에서 가장 높은 4.761㎎/L의 lancemaside A의 함량이 검출되었으며, 일반 식 물체의 줄기에서는 3.412㎎/L의 함량을 보여 T2식물체의 lancemaside A가 1.4배 많았다. T1식물체의 뿌리에서는 3.516㎎/L의 lancemaside A 함량을 보였고, 2.340㎎/L의 함 량이 축적된 일반식물체 보다 1.5배 많았다. 잎에서의 사포닌 함량은 형질전환 식물체 T1, T2 와 일반식물체에서 모두 절 간과 뿌리에 비해 1/3정도의 낮은 함량이 확인되었으나, T2식 물체의 잎에서의 lancemaside A의 함량이 1.164㎎/L으로 T2 식물체의 0.349㎎/L와 일반식물체 0.387㎎/L와 비교해 각 7.4배, 8.6배의 함량 차이를 보였다 (Fig. 2A). Lancemaside B 역시 줄기에서 가장 많은 축적이 확인되었으며, 일반식물체 의 줄기보다 T2식물체의 줄기에서 1.7배 많은 함량이 포함되 어 있었다. 잎에는 일반식물체 0.028㎎/L 그리고 T1식물체 0.0197㎎/L T2식물체 0.0348㎎/L의 함량이 포함되어 형질전 환 식물체와 일반식물체 간 큰 차이를 보이지 않았다. 뿌리에 는 T1식물체가 다른 식물체와 비교해 2.3배 높은 lancemaside B 함량을 보였다 (Fig. 2B). 4가지 다른 더덕 사포닌의 함량 과 비교해 lancemaside E는 가장 낮은 축적함량을 나타냈 으며, 그중 T2식물체의 줄기에서 0.072㎎/L로 가장 높은 함 량을 보였다. 잎은 T2식물체에서만 소량이 함유되어 있었고, 뿌리에서는 T1라인에 0.035 ㎎/L의 축적함량을 보여 일반 식물체와 비교해 3.3배의 높은 함량차이를 보였다. T2식물 체의 뿌리에서 lancemaside E는 관찰되지 않았다 (Fig. 2C). Foetidissimoside A는 더덕 이외에도 호박속 (Cucurbita)에 속 하는 Cucurbita foetidissima에서 가장 먼저 발견된 사포닌이 다 (Gaidi et al., 2000). T2식물체의 줄기에서 0.069㎎/L으 로 가장 높은 함량이 축적되어 일반식물체 줄기와 비교해 2배 이상 높은 축적량을 보였다. 잎에서의 축적량은 T2식물체의 잎에서 일반식물체와 비교해 1.4배 높은 축적량을 보였다. 뿌리에서는 T2식물체에서 일반식물체보다 2.9배 높은 Foetidissimoside A 축적량을 보였다 (Fig. 2D). Aster saponin Hb는 참취속 (Aster)에 속하는 개미취 (Aster tataricus L.)에 서 처음 발견된 사포닌으로 더덕 외에도 맥문동 뿌리에서도 추출된다고 보고하고 있다 (Ryuichiro et al., 1990). Aster saponin Hb는 T2식물체의 줄기에서의 함량이 0.1018㎎/L로 가장 높았으나, 일반식물체의 줄기에서의 함량과 큰 차이를 보 이지 않았다. 잎에서의 함량은 T1식물체에서 0.032㎎/L로 일 반식물체의 잎과 비교해 1.3배 높게 나타났다. 뿌리는 일반 식물체 그리고 형질전환식물체 T1, T2에서의 함량이 0.0073 ~ 0.0081㎎/L로 Aster saponin Hb는 차이를 보이지 않 았다 (Fig. 2E). 전체 사포닌 함량은 형질전환식물체와 일반식 물체의 줄기에서 가장 높게 나타났으며, 일반식물체와 비교해 형질전환식물체 T2에서 가장 함량이 높게 나타났다. 잎에서의 전체 사포닌 함량 역시 형질전환식물체 T2에서 일반식물체의 함량과 비교하여 2.2배 높게 나타났다. 뿌리에서의 전체 사포 닌 함량은 T1에서 가장 높았으며, 일반식물체와 비교해 1.6배 높게 나타났다 (Fig. 2F).
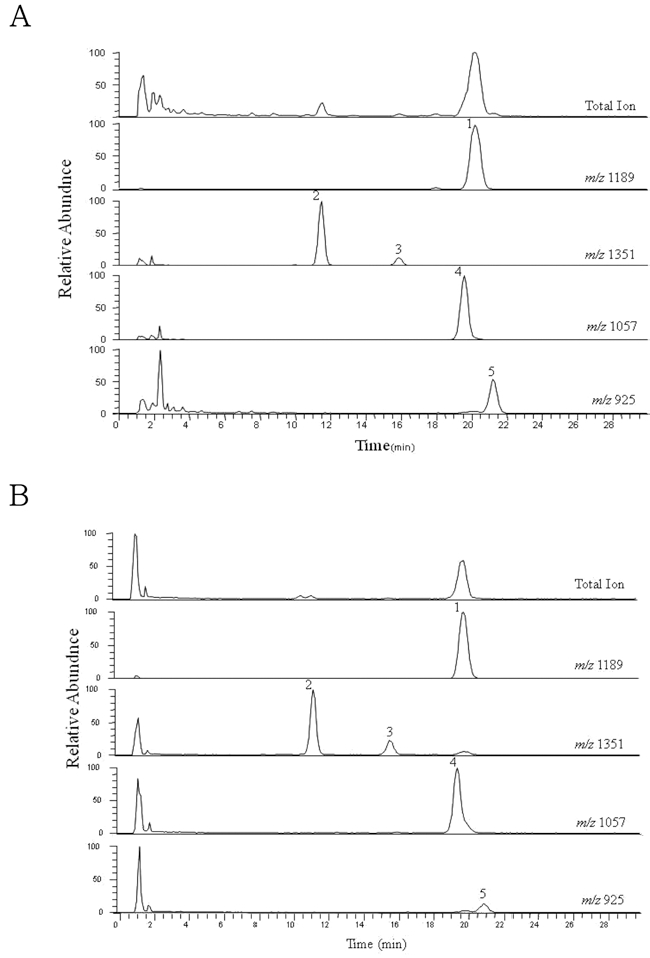
모상근은 이차대사물질 함량 증대와 대량생산를 위한 형질 전환 방법으로 본 연구에서는 유도된 더덕 모상근을 재료로 형질전환 식물체를 유도하여 부위에 따른 사포닌 축적 함량을 분석하였다. 그 결과 모상근유래 식물체 또한 일반 더덕식물 체와 비교해 전체 사포닌 함량이 증가된 것을 확인하였다. 스 탠다드 컨트롤과 T2라인식물체 줄기내의 대표적인 ion chromatographs는 Fig. 3에서 보여주고 있다.
모상근 유도를 위한 A. rhizogenes의 rol유전자 중 rolC 유 전자는 이차대사물질 증진에 관여하며, Bulgakov 등 (1998)은 인삼세포에 rolC 유전자를 삽입하여 ginsenoside의 함량을 분 석한 결과 rolC 유전자를 삽입한 모상근에서 전체 ginsenoside 의 양이 형질전환하지 않은 부정근 보다 35배 정도 높아졌으 며, 그 외 몇몇의 rolC 형질전환 식물체의 이차 대사물질의 함량 증대에 관여한다는 보고가 있다 (Bonhomme et al., 2000; Palazón et al., 1998). 본 연구에서 역시 RT-PCR을 통한 발현량 분석을 통해 더덕 모상근의 rolC 유전자는 다른 rol 유전자와 비교하여 발현양이 높았다 (데이터 미제시). 이러 한 결과는 rolC 유전자는 이차대사물질 생산에 있어 중요한 촉매제 역할을 할 수 있다는 것을 보여주는 결과이다.
이전 Ichikawa 등(2009)의 연구에서는 노지에서 재배된 재 배더덕의 뿌리내에 축적된 사포닌 함량을 분석하였는데, 본 연 구에서의 흥미로운 결과는 이전 연구에서 보고된 더덕 뿌리 내 사포닌 함량과 이번 연구결과의 형질전환더덕 줄기 내 사 포닌 함량의 값이 유사하다는 것이다. 또한 형질전환더덕과 일 반더덕에서 줄기의 사포닌 축적함량이 뿌리보다 더 높았다는 것이다. 이러한 결과는 더덕의 triterpenoid 사포닌은 형질전환 방법을 이용하여 단시간에 노지재배더덕과 유사한 함량을 대 량으로 얻을 수 있다는 것이다. 형질전환더덕과 더불어 일반 노지더덕 재배 시 쓸모없던 대량의 더덕줄기를 사포닌을 생산 하는데 재료로 활용할 수 있다는 것이다. 또한 lancemaside A 등 특정 성분이 밝혀진 사포닌 함량을 임으로 높이거나 낮추 어 가공용 식품원료 및 약용성분 등으로 활용이 가능할 것 이다. 이상의 결과들은 향후 더덕의 형질전환 식물체 생산을 통한 triterpenoid 사포닌의 산업적 생산이 가능할 것으로 사료 된다.
REFERENCES
- Bonhomme, V, Laurain, MD, Fliniaux, MA, Effects of therolC gene on hairy root: Induction development and tropane aAlkaloid production byAtropa belladonna, Journal of Natural Products, (2000), 3, p1249-1252.
-
Bulgakov, VP, Khodakovskaya, MV, Labetskaya, NV, Chernoded, GK, Zhuravlev, YN, The impact of plantrolConcogene on ginsenoside production by ginseng hairy root cultures, Phytochemistry, (1998), 49, p1929-1934.
[https://doi.org/10.1016/s0031-9422(98)00351-3]

- Cho, KJ, Jang, JE, Ryou, CS, Kwon, MS, Development of transgenic plant(Codonopsis lanceolata) harboring a bialaphos resistance gene, bar, Korean Journal of Plant Tissue Culture, (1999), 26, p281-287.
-
Choi, HK, Won, EK, Jang, YP, Choung, SY, Antiobesity effect ofCodonopsis lanceolatain high-calorie/ high-fat-diet-induced obese rats, Evidence-Based Complementary and Alternative Medicine, (2013), p9-17.
[https://doi.org/10.1155/2013/210297]

-
Gaidi, G, Marouf, A, Hanquet, B, Bauer, R, Correia, M, Chauffert, B, Lacaille-Dubois, MA, A new major triterpene saponin from the roots ofCucurbita foetidissima, Journal of Natural Products, (2000), 63, p122-124.
[https://doi.org/10.1021/np9902800]

-
Ichikawa, M, Ohta, S, Komoto, N, Ushijima, M, Kodera, Y, Hayama, M, Shirota, O, Sekita, S, Kuroyanagi, M, Simultaneous determination of seven saponins in the roots ofCodonopsis lanceolataby liquid chromatography-mass spectrometry, Journal of Natural Medicines, (2009), 63, p52-57.
[https://doi.org/10.1007/s11418-008-0294-4]

-
Gorpenchenko, TY, Kiselev, KV, Bulgakov, VP, Tchernoded, GK, Bragina, EA, Khodakovskaya, MV, Koren, OG, Batygina, TB, Zhuravlev, YN, The Agrobacterium rhizogenes rolC-gene-induced somatic embryogenesis and shoot organogenesis in Panax ginseng transformed calluses, Planta, (2006), 223, p457-467.
[https://doi.org/10.1007/s00425-005-0102-2]

-
Joh, EH, Lee, IA, Han, SJ, Chae, SJ, Kim, DH, Lancemaside A ameliorates colitis by inhibiting NF-κB activation in TNBS-induced colitis mice, International Journal of Colorectal Disease, (2009), 25, p545-551.
[https://doi.org/10.1007/s00384-009-0858-0]

-
Joh, EH, Jeong, JJ, Kim, DH, Inhibitory effect of echinocystic acid on 12-O-tetradecanoylphorbol-13-acetateinduced dermatitis in mice, Actives of Pharmacal Research, (2014), 37, p225-231.
[https://doi.org/10.1007/s12272-013-0092-8]

- Jung, IH, Jang, SE, Joh, EH, Chung, J, Han, MJ, Kim, DH, Lancemaside A isolated fromCodonopsis lanceolataand its metabolite echinocystic acid ameliorate scopolamineinduced memory and learning deficits in mice, Phytomedicine, (2012), 20, p84-88.
-
Kim, JA, Park, EJ, Choi, YE, Induction and proliferation of adventitious roots inCodonopsisspp, Korean Journal of Medicinal Crop Science, (2012), 20, p493-499.
[https://doi.org/10.7783/kjmcs.2012.20.6.493]

-
Kim, JS, Kim, JW, Kwon, HS, Lim, HW, Lee, HY, Screening of skin whitening activity ofCodonopsis lanceolataextract by complex steaming process, Korean Journal of Medicinal Crop Science, (2013), 21, p54-60.
[https://doi.org/10.7783/kjmcs.2013.21.1.54]

-
Min, SR, Yang, SG, Liu, JR, Choi, PS, Soh, WY, High frequency somatic embryogenesis and plant regeneration in tissue cultures ofCodonopsis lanceolata, Plant Cell Reports, (1992), 10, p621-623.
[https://doi.org/10.1007/bf00232383]

-
Murashige, T, Skoog, F, A revised medium for rapid growth and bio assays with tobacco tissue cultures, Physiologia Plantarum, (1962), 15, p473-497.
[https://doi.org/10.1111/j.1399-3054.1962.tb08052.x]

-
Palazn, J, Cusid, RM, Roig, C, Piol, MT, Expression of therolC gene and nicotine production in transgenic roots and their regenerated plants, Plant Cell Reports, (1998), 17, p384-390.
[https://doi.org/10.1007/s002990050411]

- Ryuichiro, T, Tsuneatsu, N, Hikaru, O, Tatsuo, Y, Studies on the constituents ofAster tataricusL. f. IV. : Structures of aster saponins isolated from the herb, Chemical and Pharmaceutical Bulletin, (1990), 38, p1153-1157.
- Sekita, S, Kuroyanagi, M, Yasuda, K, Mizuno, I, Ushijima, M, Hayama, M, Ichikawa, M, Sumihiro, M, Drug for ameliorating male climacteric disorder, U.S. Patent 20080274213 A1, (2005).
-
Song, CH, Seo, YC, Choi, WY, Lee, CK, Kim, DU, Jung, JY, Jung, HC, Park, DS, Ma, CJ, Lee, HY, Enhancement of antioxidative activity ofCodonopsis lanceolataby stepwise steaming process, Korean Journal of Medicinal Crop Science, (2012), 20, p238-244.
[https://doi.org/10.7783/kjmcs.2012.20.4.238]

- Ushijima, M, Mizuno, I, Suzuki, E, Amayasu, R, Ishii, S, Nishihama, T, Morihara, N, Kashimoto, N, Mouri, Y, Sumioka, I, Improvement of PADAM-like symptoms in middle-aged men by a designer food containingCodonopsis lanceolata, Pharmacometrics, (2007), 72, p23-30.